维真生物采用2代慢病毒包装系统来制备慢病毒。该系统为三质粒系统,包括1个包装质粒(psPAX2)、1 个包膜质粒(pMD2G)、1个目的基因质粒和1株包装细胞(293T cell)。下图是慢病毒制备流程示意图:
|
|
1. 重组慢病毒的制备
| Day1: | 汇合度90%的10cm dishs HEK293T细胞(~ 6×107/dish)按1:1比例传代至15cm dishs,第二天细胞汇合度达到90%-95%(~ 1.5×108/dish),培养基为Gibico高糖DMEM培养基(含10%FBS)。 | ||||||||||||||||
| Day2: |
1)转染前2-3个小时更换培养基(含10%FBS);
Mix 1和Mix 2分别混合后,室温5-10min, 后将Mix 1和Mix 2混合,室温30min,加入至15cm dish中。(细胞达到汇合度90%,细胞过少会影响转染效率) |
||||||||||||||||
| Day3: | 6h-24h内更换新鲜培养基(含10%FBS),观察转染效率并拍照。 | ||||||||||||||||
| Day5: | 72h观察细胞状态并拍照。收取上清培养基,过0.45μm滤膜,上清培养基加入超速离心管中,配平后离心,25000rpm,4℃离心1.5h。弃上清,用适当病毒保存液回溶混匀溶解过夜。 | ||||||||||||||||
| Day6: | 收集病毒分装,进行病毒滴度测定。 |
2. 重组慢病毒滴度测定
2.1 整合数法标定不带荧光的重组慢病毒滴度
2.1.1 病毒感染细胞
①感染前6 h 在24孔细胞培养板中以2.5×105个细胞/孔 均匀接种HEK293细胞。
②将慢病毒进行梯度稀释,共做3个梯度,即每孔(500μl 无双抗、无血清的DMEM培养基)中含10 μl、1 μl、0.1 μl 病毒,振荡混匀后加至接种好细胞的24孔板中,加病毒之前将培养板中的培养基吸净。
③感染 18-20h 后,将培养板中的培养基更换为新鲜的DMEM完全培养基。
④感染 64-68h 后收集细胞并进行基因组DNA的提取。
⑤测定时,设置一组带荧光的已知TU的慢病毒作为对照,以校验检测出的数值。
2.1.2 提取基因组DNA(按照AxyGEN 的基因组DNA提取试剂盒说明书进行操作)
2.1.3 qPCR检测
① 以被测慢病毒载体梯度稀释为标准品,慢病毒载体上的通用引物进行qPCR以获得病毒整合拷贝数。
② 以Actin质粒梯度稀释为标准品,Actin引物进行qPCR检测样品的基因组拷贝数以得到基因组拷贝数。
③ qPCR
qPCR反应体系如下:
| 组成成分 | 体积 |
| 2 × SYBR Green mix | 10 μl |
| Primers (Forward & Reverse mixture) | 0.8 μl |
| 超纯水(DNase & RNase Free) | 7.2μl |
| 模板 | 2μl |
| Total | 20μl |
qPCR反应程序:
| 循环参数 | |
| 预变性95℃ | 3min |
| 95℃ | 5S |
| 60℃ | 15S |
| 72℃ | 15S+Plate Read |
| 39个循环 | |
2.1.4 计算慢病毒IU(Integration Unit)ml-1
IU ml-1=(C×N×D×1000)/V
| 注: | C=平均每基因组慢病毒整合拷贝数 | D=病毒的稀释倍数 |
| N=感染时细胞的数目(约为2.5×105) | V=加入稀释病毒的体积数 |
2.2 孔稀释法标定带荧光的重组慢病毒滴度
| Day1: |
细胞的准备 在96孔板中的每个孔中接种1-4×104个 HEK293细胞。 |
||||||||||||||||||||||||
| Day2: |
病毒的稀释与感染
在Eppendorf管中做10倍梯度稀释,分别是1~10-6梯度。弃去96孔板中原有的培养基,将稀释好的病毒依次加入孔中,注意是两个重复,并做好标记。
|
||||||||||||||||||||||||
| Day5: |
荧光计数与滴度计算 感染72h后,用荧光显微镜对荧光阳性细胞进行计数。数出最后两孔的荧光细胞数,计算2个重复孔内的总数之和并计算出平均数,假设为A(倒数第二孔的荧光细胞平均数)和B(倒数第一孔的荧光细胞平均数)。 慢病毒滴度计算公式: 病毒滴度 (TU/ml) = (A+B×10)×1000/2/A孔病毒量(μl) 下面是GFP慢病毒的滴度检测结果:
|
3. 慢病毒的使用
3.1 重组慢病毒体外感染细胞
不同的细胞所使用的病毒MOI值会有所不同。建议在正式实验前,在目的细胞中进行预实验摸索最佳MOI值。
3.1.1 慢病毒感染目的细胞预实验
为了节省病毒,推荐使用96孔板进行预实验。操作步骤如下:
①第一天 细胞的准备
将目的细胞接种于96孔板中,细胞融合率为50%为最佳。为保证细胞生长良好,请保证细胞贴壁过夜。
②第二天 病毒的稀释
取10μL慢病毒原液加入90μL培养液中做1:10稀释(10-1),以此为起点做梯度稀释直至稀释10-7。可根据实际情况降低或提高稀释倍数。
③第二天 感染目的细胞
取出提前准备好的96孔板,用准备好的病毒稀释液替代旧培养液,注意保留未加入病毒的细胞孔作为对照组。
④第二至十天 观察荧光或检测
慢病毒对细胞的感染较慢,请在感染细胞后48、72、96、120小时分别观察细胞中荧光表达情况(如果您选择的产品不带有荧光标签,请在48、72、96、120小时分别收获细胞并通过 Western-Blot 或其他检测手段来检测基因表达)。
|
注意: |
由于不同细胞对慢病毒感染过程的承受能力不同,在加入病毒稀释液后,请于12-24小时后观察细胞状态以确认加入的病毒量是否合适。
|
3.1.2 慢病毒感染目的细胞
进行慢病毒感染实验时可使用完全培养液(培养目的细胞用)稀释。培养液中的血清、双抗或其他营养因子不会影响慢病毒的感染效率。
以24 孔培养板为例,进行HEK293细胞的感染实验操作步骤如下:
|
注意: |
实验前请按照不同的MOI 设置不同的感染孔,并根据MOI 和细胞数量计算所需要的病毒量。
|
① 第一天 细胞的准备
在24孔培养板接种若干孔,每个孔内接种3-5×104个HEK 293细胞,铺板时细胞的融合率为50%左右,每孔培养液体积为300μL,进行病毒感染时细胞的汇合度约为70%。
②第二天 病毒的准备
根据实验的实际情况和MOI 值,用培养液准确稀释慢病毒原液。
|
注意: |
可使用PBS缓冲液或无血清培养液稀释病毒原液。
|
③第二天 感染目的细胞
在目的细胞和对照细胞中分别加入计算好的病毒液, 混匀后放于CO2培养箱(37 ℃、5% CO2)孵育过夜。
|
注意: |
1)感染前细胞的状态好坏对最终的感染效果高低影响很大,请务必保证加入病毒前,细胞处于良好的生长状态。 2)若慢病毒对目的细胞的感染效率较低,可通过提高MOI 值提高病毒的感染效率,也可在培养液中加入维真生物助感染试剂ADV-HR来提高病毒的感染效率。
|
④第三天 更换培养液
病毒感染细胞24小时后,更换培养液。
|
注意: |
换液具体时间需视细胞状态而定。如果慢病毒对细胞有明显毒性作用,影响细胞生长状态,最短可于加病毒4小时后更换新鲜培养液后继续培养。
|
⑤第六天 感染效率检测
在倒置荧光显微镜观察荧光,计算慢病毒感染目的细胞的效率。如选择的慢病毒载体不带有荧光标记,可以通过Q-PCR(定量PCR)检测目的基因的表达来评估感染效率。
|
注意: |
1)慢病毒表达较慢,荧光表达所需时间较长,建议感染96小时后观察荧光的表达。 2)感染后的细胞可以连续培养一周,通过观察荧光表达的时间和强度来确定慢病毒对目的细胞的感染情况。 3)感染期间,请根据细胞生长的情况及时换液,以保证细胞良好的生长状态。
|
|
附件1:载体选择 |
|
基因过表达 |
||
|
|
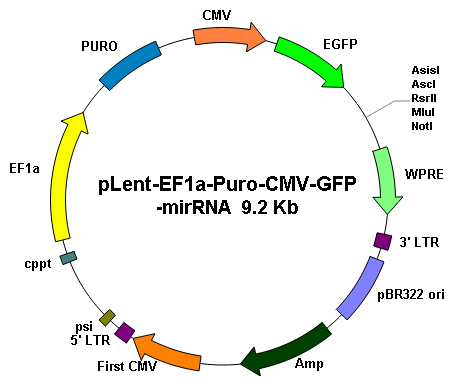 |
 |
|
基因沉默 |
||
|
|
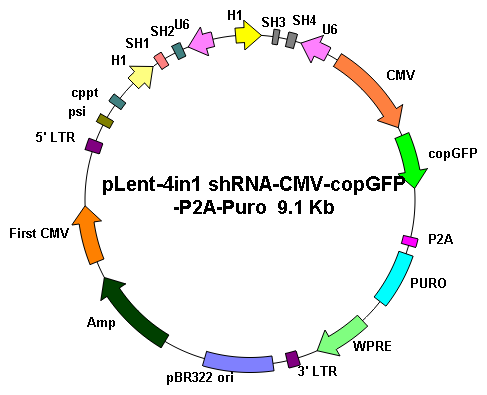 |
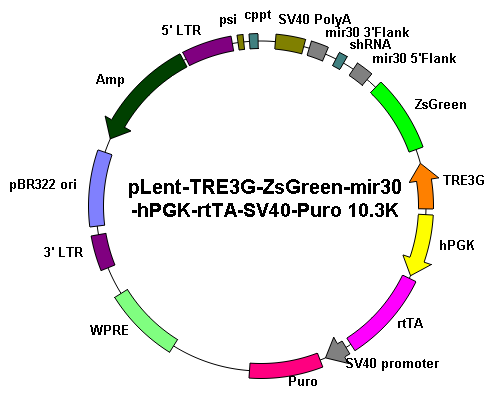 |
|
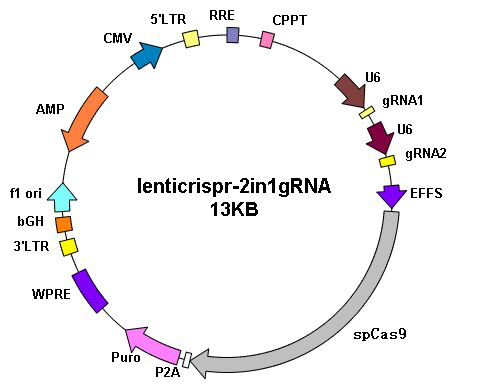
基因编辑 |
||
|
|
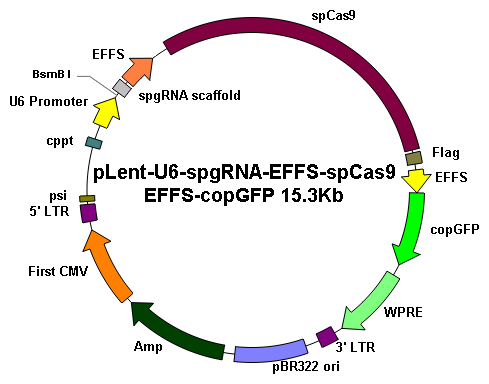 |
 |
|
附表2:耗材 |
| 耗材名称 | 货号 | 品牌 |
| 细胞培养板 10cm | 704001 | NEST |
| 细胞培养板 15cm | 715001 | NEST |
| 10ml血清移液管 | 4488 | Corning |
| 50ml血清移液管 | 4490 | Corning |
| 100-1250无菌加长带刻度滤芯枪头 | TF112-1000-Q | QSP |
| 细胞冻存管 | 377267 | Corning |
| DMEM高糖培养基 | C11965500BT | GIBICO |
| HEPES溶液 1M | SH30237.01 | HyClone |
| 青霉素-链霉素溶液(100*) | C0222 | 碧云天 |
| 胎牛血清 | 1122050 | Gibico |
| 0.25%胰蛋白酶 | SH30042.01 | Hyclone |
| 10xPBS | ST476 | 碧云天 |
| DMSO | D8372 | SOLARBIO |
|
附表3:仪器 |
| 仪器名称 | 规格型号 | 品牌 |
| 生物安全柜 | BSC-1300IIA2 | 苏净集团苏州安泰空气技术有限公司 |
| 倒置显微镜 | CKX31SF | OLYMPUS |
| 实时荧光定量扩增仪(QPCR仪) | CFX96 | BIO-RAD |
| 荧光显微镜 | ELWD0.3 | Nikon |
| 超低温保存箱 | DW-86L386 | 青岛海尔特种仪器有限公司 |
| 台式高速冷冻离心机 | 1580R | LAB GENE 基因有限公司 |