RNA编辑神器CasRx
CRISPR/Cas13系统是目前发现的唯一能够降解RNA的蛋白,该系统的发现扩展了CRISPR系统在病毒干扰方面的应用。CRISPR/CasRx系统是新发现的Cas13蛋白第四种亚型(Cas13d)的家族成员,在体内外哺乳动物细胞的RNA裂解过程中显示出更强的特异性和更高的敲除效率,而且CasRx比之前发现的所有亚型都要小很多,更容易利用AAV载体实现体内的运输,因此在RNA编辑方面具有很大的应用前景。
维真生物提供CasRx AAV载体(服务内容见下面),基因编辑效率更高,效果更好,欢迎各位老师交流订购!
|
服务编号 |
服务类型 |
规格 |
目录价 |
货期 |
|
WZ140001 |
单条gRNA质粒构建 |
5μg质粒+500uL菌液 |
¥1200.00 |
2-3周 |
|
WZ140002 |
2in1gRNA质粒构建 |
5ug质粒+500ul菌液 |
¥2400.00 |
2-3周 |
|
WZ140003 |
CasRx质粒构建 |
5ug质粒+500ul菌液 |
询价 |
咨询 |
*如您对上述服务感兴趣,请您点击“欢迎垂询”留下您的信息,我们将为您提供具体实验方案和项目价格。
相关服务: 腺病毒包装 慢病毒包装 腺相关病毒 CRISPR/Cas9克隆 shRNA克隆服务
|
↓↓ 分以下几个部分做详细介绍 ↓↓ |
2016年,科学家发现了可以靶向RNA进行切割的CRISPR/Cas13系统,该系统由单一的效应蛋白Cas13和CRISPR RNA(crRNA)组装形成一个由crRNA引导的RNA靶向效应复合物。目前,Cas13家族共鉴定出四种亚型,包括Cas13a(又名C2c2)、Cas13b、Cas13c和Cas13d,四种Cas13亚型蛋白分子量均小于Cas9蛋白。
所有Cas13蛋白均具有两种不同的催化活性:
①由两个较高等的真核和原核核苷酸结合(Higher eukaryotes and prokaryotes nuceotide-binding,HEPN)结构域提供的RNase活性,这是靶RNA降解所必需的。Cas13 四个亚型同源性较低,且同源序列仅限于HEPN结构域位点,此外两个HEPN结构域中的单点突变会使CRISPR/Cas13系统对RNA的切割能力完全丧失;
②催化pre-crRNA加工和形成成熟crRNA的RNase活性。
|
|
图1.CRISPR/Cas9系统的作用原理(Zhang Feng,2013)
与CRISPR II类系统的其它核酸酶结构一致,Cas13a的整体结构是双叶的,N-末端结构域(N-terminal domain,NTD)和Helical-1结构域构成crRNA识别叶(REC lobe),HEPN1、Helical-2、HEPN2结构域形成核酸酶叶(NUC lobe)(图2)。CRISPR/Cas13b系统有两种酶,分别是VI-B1和VI-B2,它们之间的区别在于Cas13b转座子上携带的附属蛋白的基因型不同,VI-B1的附属蛋白是Csx28,而VI-B2的附属蛋白是Csx27。绝大多数Cas13d型系统还含有包含 WYL结构域的相关辅助蛋白,WYL结构域通常与原核防御系统有关(图1)。
|
|
图2.Cas13a蛋白结构域示意图
所有的Cas13蛋白酶都需要60- 66 nt的crRNA来确保靶向特异性。四种亚型crRNA都有一个促进与相应Cas13蛋白酶结合的直接重复(Direct repeat,DR)以及特异性靶向转录本的间隔序列。Cas13b的crRNA在3’端携带直接重复,而Cas13a、c和d的crRNA在5’端携带直接重复(图3)。
|
|
图3.Cas13a蛋白结构域示意图
主要包括以下几个阶段(以Cas13a为例):
①pre-crRNA 的识别与结合。新转录的pre-crRNA通过crRNA的5’端茎环结构与Cas13a的REC叶识别并结合,形成pre-crRNA与Cas13a复合物的中间过渡态;
②成熟crRNA的形成。NUC区的Helical-1和HEPN2结构域之间保守残基的构象发生变化,从而形成一个酸碱催化中心,催化酶切pre-crRNA形成成熟的crRNA。此时的crRNA-Cas13a复合物处于无酶切活性状态;
③crRNA-Cas13复合物酶切活性的激活。靶ssRNA进入crRNA-Cas13a复合物内与crRNA发生碱基互补配对,诱发Cas13a发生构象变化,从而激活crRNA-Cas13a复合物的酶切活性;
④靶RNA的降解。在crRNA的引导下,Cas13a的HEPN结构域催化靶ssRNA的酶切。有时细菌细胞中会出现非特异性酶切的情况,导致细胞中其他附属ssRNA的降解,引起一定的细胞毒性,但这种现象在哺乳动物细胞中并未出现,其原因目前尚未可知。(图4)。
|
|
图4.CRISPR/Cas13系统作用机制示意图
2018年,加州大学伯克利分校Patrick D. Hsu实验室发现了靶向RNA的Cas13d家族,Cas13d平均大小为930 aa,是目前发现的哺乳动物细胞中相对较小的Ⅱ类CRISPR效应因子(比其家族成员Cas13a-c小20%,比Cas9小33%),使它更容易包装到容量有限的应用载体如AAV载体中。此外,Cas13d对RNA靶点的切割不依赖于PFS序列(protospacer flanking sequence,相当于Cas9针对DNA的PAM序列),这极大的增加了Cas13d的应用范围,使其成为进一步开发靶向RNA工具的潜在平台。与RNA干扰技术相比,Cas13d介导的基因沉默具有更高的特异性(与数百个shRNA脱靶相比,Cas13d没有脱靶)和敲除效率(Cas13d达到96%,shRNA达到65%, CRISPRi达到53%)。而与Cas9介导的基因敲除技术相比,Cas13d介导的基因沉默不会改变基因组DNA,因此这种基因沉默是可逆的,对一些后天性疾病的治疗更有优势(图5,6)。
|
|
图5.一种引导和靶向激活Cas13d核糖核酸酶活性的模型
|
|
图6.Cas13d系统具有更高的特异性和敲除效率
▽ 体外实验:
2020年的一项研究探索了使用CasRx系统来定向沉默基因的可行性。首先,研究者选择Pten作为代谢调控基因,研究CasRx是否能以代谢基因为靶点进行有效的基因敲除,并制备了多个针对Pten mRNA编码序列的sgRNAs,研究者将CasRx和每个Pten sgRNA通过质粒转导至小鼠神经母细胞瘤N2a细胞中,并进行sgRNA的体外筛选,找到了CasRx敲低目的基因的最佳sgRNA组合:sgPten-5和sgPten-6。结果显示,在转染CasRx、sgPten-5和sgPten-6的N2a细胞中,Pten的表达水平显著降低,AKT的磷酸化水平显著升高,此外与shRNA系统相比,CasRx编辑系统表现出来更强的特异性和更低的脱靶率(图7)。(延伸理解:Pten被认为是一种代谢调节剂,通过抑制PI3K/AKT途径抑制胰岛素信号转导通路,Pten的缺失能促进AKT的磷酸化)
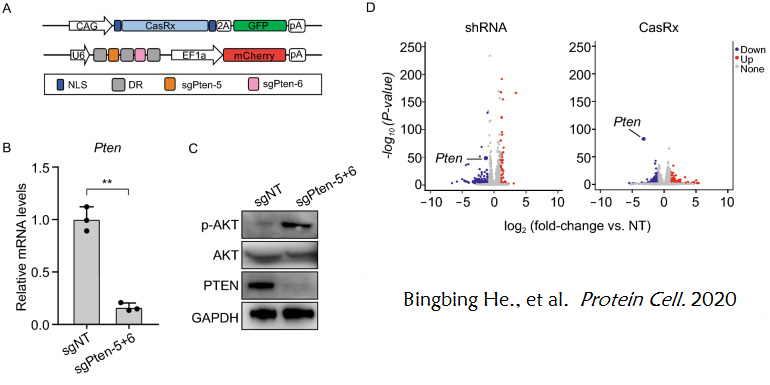
图7. CasRx体外介导Pten的敲除
▽ 体内实验:
研究人员通过尾静脉注射敲低Pcsk9的AAV8病毒,显著降低了肝脏和血清中Pcsk9的表达量以及血清中的胆固醇水平。重要的是,CasRx介导的Pcsk9敲低是可逆的,Pcsk9表达水平可以反复下调。CRISPR/CasRx系统为可逆调节代谢基因,尤其是一些后天性疾病(如因不良生活习惯导致的高血脂等后天代谢性疾病等)提供了一种有效的策略(图8)。
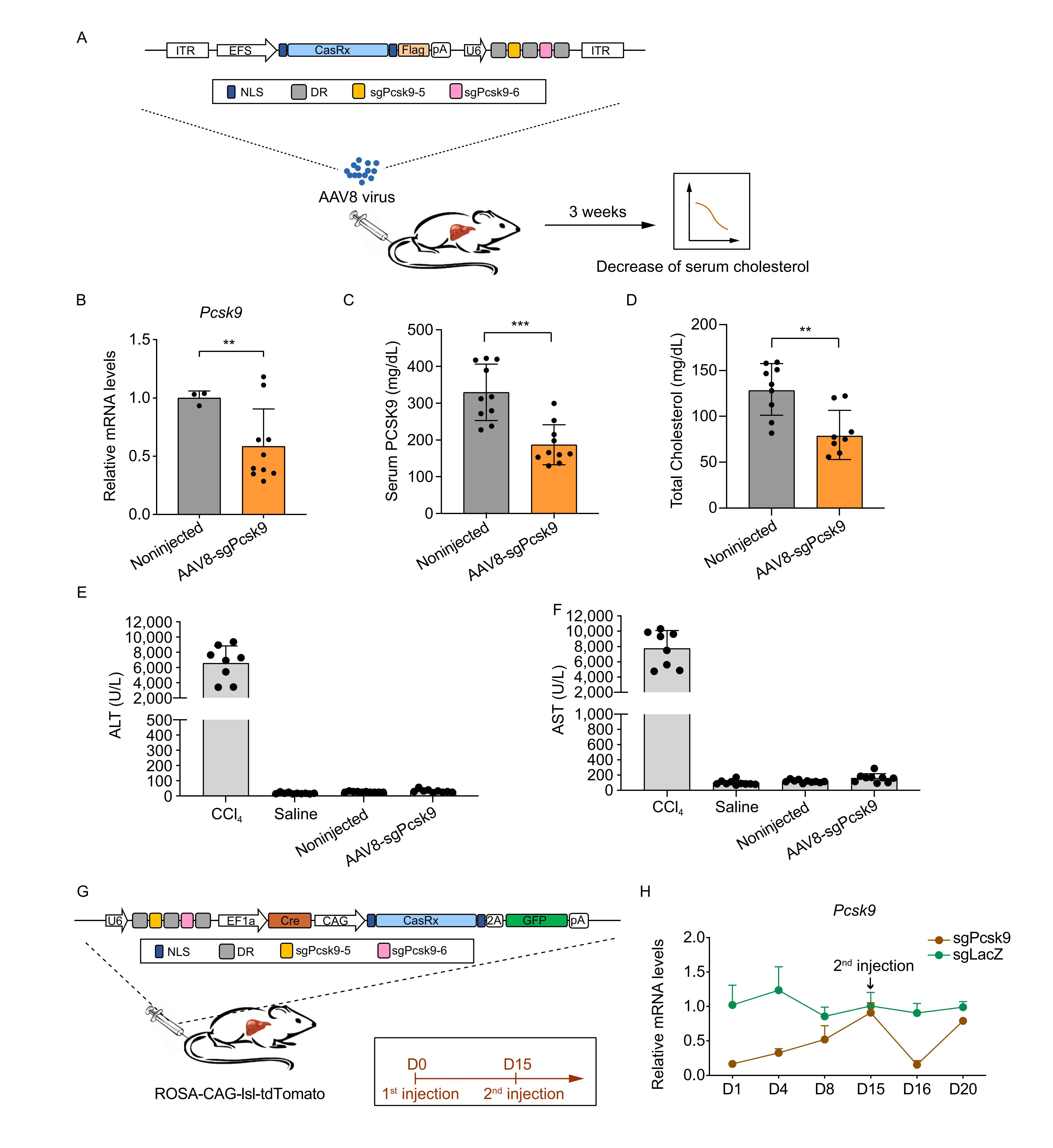
图8. CasRx介导的血清胆固醇降低和PCSK9可逆调节
|
↑↑ 点击返回,查看其它部分 ↑↑ |
|
▽ 部分CasRx腺相关病毒(AAV)载体 ▽ |
|
| pAV-CMV-nls-CasRx | pAV-CMV-nls-CasRx-P2A-GFP |
| pAV-U6-gRNA-CMV-nls-CasRx | pAV-U6-gRNA-CMV-nls-CasRx-P2A-GFP |
▽ 实验检测结果 ▽
维真科研团队针对mcherry基因设计了多条gRNAs,并选择了其中两条敲除效果好的gRNAs(gRNA1和gRNA2),进行了单条gRNA、2in1 gRNAs敲除效果的验证试验,结果如下:
|
|
从上述荧光图可看出,2in1 gRNAs敲除组,mCherry表达水平大大降低,敲除效果明显好于单条gRNA的敲除效果。
|
|
(mcherry表达量:gRNA1组 0.38;gRNA2组 0.47;gRNA1+2组 0.18)
此外,从上图mCherry mRNA表达量的检测实验结果可以看出,Cas13d(CasRx)-gRNA系统可以特异高效地降低靶向基因的表达(mCherry),并且2 in1gRNAs 能实现mRNA水平敲低82%!
使用AAV载体构建克隆,40多种组织特异性启动子和多种报告基因可供客户选择。
可根据客户具体实验,由公司专业技术人员提供载体构建方案,提供特殊定制服务。
常用载体
|
|
|
↑↑ 点击返回,查看其它部分 ↑↑ |
|
|
答案:可以的,已有研究证明CRISPR/CasRx系统通过使用向导RNA的靶向序列来有效地区分CircRNA与mRNA,利用这一系统能高效地敲低CircRNA的表达,并能用于功能性CircRNA的筛选。
答案:Cas13d对RNA靶点的切割不同于Cas9对DNA的切割,其不依赖于PAM序列,因此可以更灵活的的设计sgRNA,几乎可以靶向RNA的任何位置,这也保证了其极高的敲除效果。
资料完善中…