腺相关病毒包装服务
腺相关病毒(Adeno-associated virus)属于细小病毒科,Dependoparvovirus属,是目前发现的一类结构简单、无包膜的单链DNA缺陷型病毒,它的生命周期依赖于复制病毒的参与,如腺病毒和单纯疱疹病毒。野生型的腺相关病毒可以定点整合到人类第19号染色体的AAVS1位点,而重组腺相关病毒由于缺少整合和复制必需的两个基因而无法整合。因此,重组腺相关病毒主要以游离于染色体的附加体形式存在,并可长时间存在于非分裂细胞中。另外,腺相关病毒具有高组织特异性、良好的扩散性、低免疫原性、高安全性和稳定性。基于以上特点,重组腺相关病毒已经成为科研和基因治疗中具市场前景的病毒载体之一。
根据客户的个性化实验需求,维真生物提供优质的腺相关病毒包装服务。下面是具体服务内容(目录价仅为病毒包装费用):
| 服务编号 | 服务类型 | 规格 | 目录价 | 货期 |
|---|---|---|---|---|
| WZ070001 | 小包装 | 滴度≥1×10E13 vg/ml;体积100ul | 询价 | 2周 |
| WZ070002 | 大包装 | 滴度≥1×10E13 vg/ml;体积500ul | 询价 | 2周 |
*如您对上述服务感兴趣,请您点击“欢迎垂询”留下您的信息,我们将为您提供具体实验方案和项目价格。
相关服务: 克隆服务 基因表达分析服务 AAV血清型筛选服务
|
↓↓ 分以下几个部分做详细介绍 ↓↓ |
腺相关病毒的直径在20-26nm范围内,其直径为腺病毒的1/5,慢病毒的1/4,呈现20面体结构,对分裂细胞和非分裂细胞均可感染。
腺相关病毒含有约4.7kb的单链线性DNA基因组。基因组两端为末端反向重复序列(ITR),对于病毒的复制和包装具有重要作用;中间基因组编码两类蛋白Rep和Cap,Rep蛋白参与病毒的复制和整合,Cap蛋白为病毒衣壳蛋白。衣壳包含三种类型的亚基VP1、VP2和VP3,比例为1:1:10(VP1:VP2:VP3)。基于AAV的基因组结构,基因工程化的AAV载体删除了全部AAV蛋白编码序列,添加了外源基因的表达盒。唯一的病毒来源序列是ITR,它们是在病毒包装过程中指导AAV复制和包装所必需的。病毒编码序列的完全去除使AAV的包装能力最大化,并且有助于它们在体内递送时的低免疫原性和细胞毒性。

现阶段研究人员已发现12种人类AAV 血清型(AAV1至AAV12)和 100多种非人类灵长动物AAV血清型。不同AAV血清型具有不同的衣壳蛋白空间结构、序列和组织特异性,因而其识别与结合的细胞表面受体也相应有很大差别,这也导致不同血清型转染的组织类型、细胞类型和感染效率也各不相同。表一是人类AAV1至AAV9识别的细胞表面受体;表二是AAV1至AAV9的不同组织亲噬性。
| Serotype | Glycan recognitiona | Coreceptor |
|---|---|---|
| AAV1 | Neu5Aca2-3GalNAcβ1-4GlcNAc | Unknown |
| AAV2 | 2-O-and N-sulfated heparin |
Fibroblast / hepatocyte growth factor receptor; laminin receptor; integrin αVβ5 and α5β1 |
| AAV3 | 2-O-and N-sulfated heparin | Hepatocyte growth factor receptor; Laminin receptor |
| AAV4 | Galβ1-4GlcNAcβ1-2Manα1-6Manβ1-4GlcNAcβ1-4GlcNAc | Unknown |
| AAV5 | Neu5Acα2-3(6S)Galβ1-4GlcNAc | Platelet-derived growth factor receptor |
| AAV6 | Neu5Acα2-3GalNAcβ1-4GlcNAc; N-sulfated heparin | Epidermal growth factor receptor |
| AAV7 | Unknown | Unknown |
| AAV8 | Unknown | Laminin receptor |
| AAV9 | Galactose | Laminin receptor |
| Tissue | Optimal Serotype |
|---|---|
| CNS | AAV1,AAV2,AAV4,AAV5,AAV8,AAV9 |
| Heart | AAV1,AAV8,AAV9 |
| Kidney | AAV2 |
| Liver | AAV7,AAV8,AAV9 |
| Lung | AAV4,AAV5,AAV6,AAV9 |
| Pancreas | AAV8 |
| Photoreceptor Cells | AAV2,AAV5,AAV8 |
| RPE(Retinal Pigment Epithelium) | AAV1,AAV2,AAV4,AAV5,AAV8 |
| Skeletal Muscle | AAV1,AAV6,AAV7,AAV8,AAV9 |
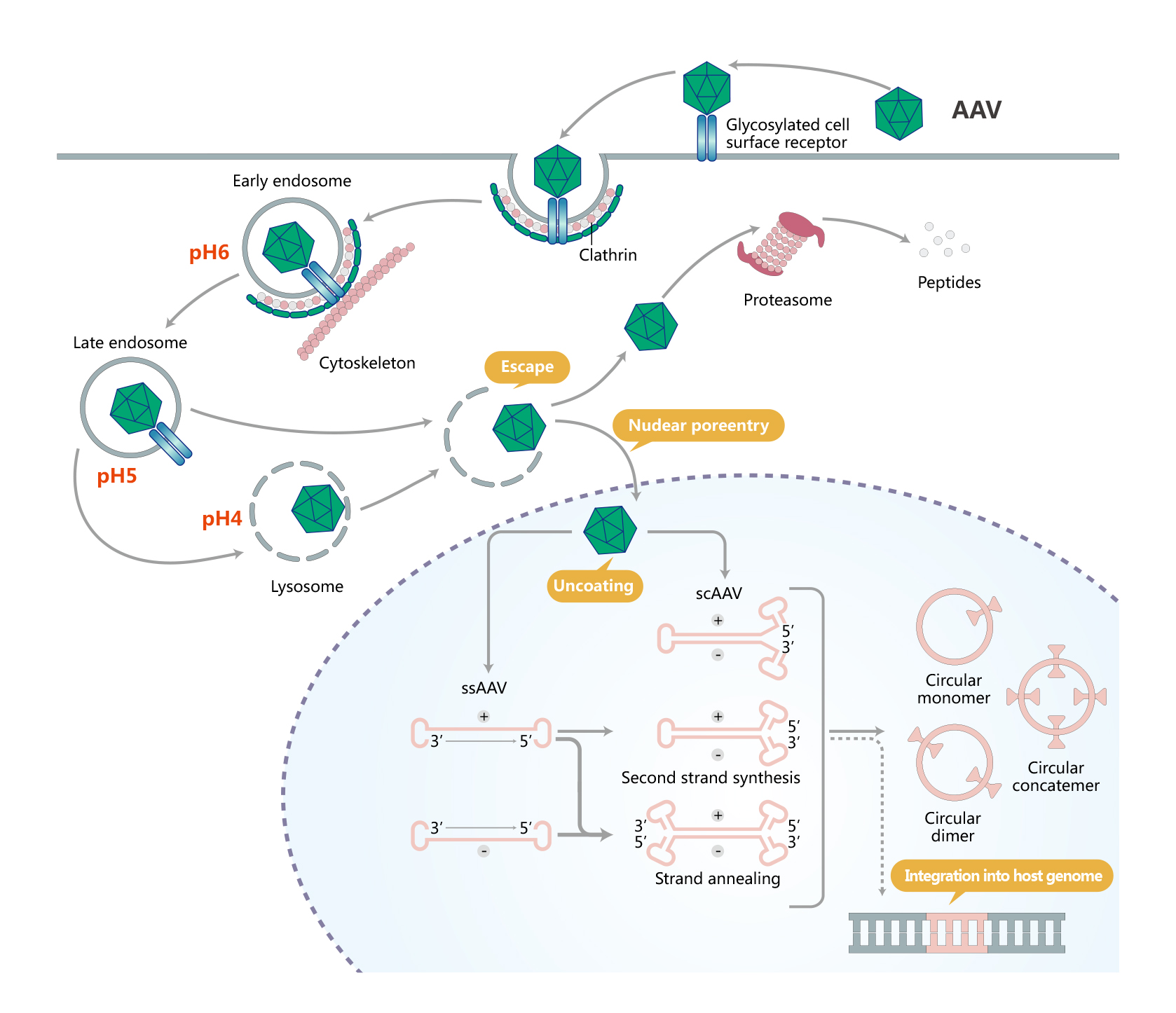
AAV转导细胞的过程起始于识别细胞表面糖基化修饰的受体,由网格蛋白介导的细胞内吞触发AAV内化入细胞胞浆,进入内体。AAV在细胞骨架蛋白网络的帮助下由细胞胞浆向细胞核运输。在内体的酸性环境下,AAV的衣壳蛋白构象发生变化。AAV逃离内体后或者由蛋白酶体进行蛋白降解,或者入核和脱衣壳,双链转化,进而形成环形附加体游离于细胞核。下图是AAV转导细胞的过程。
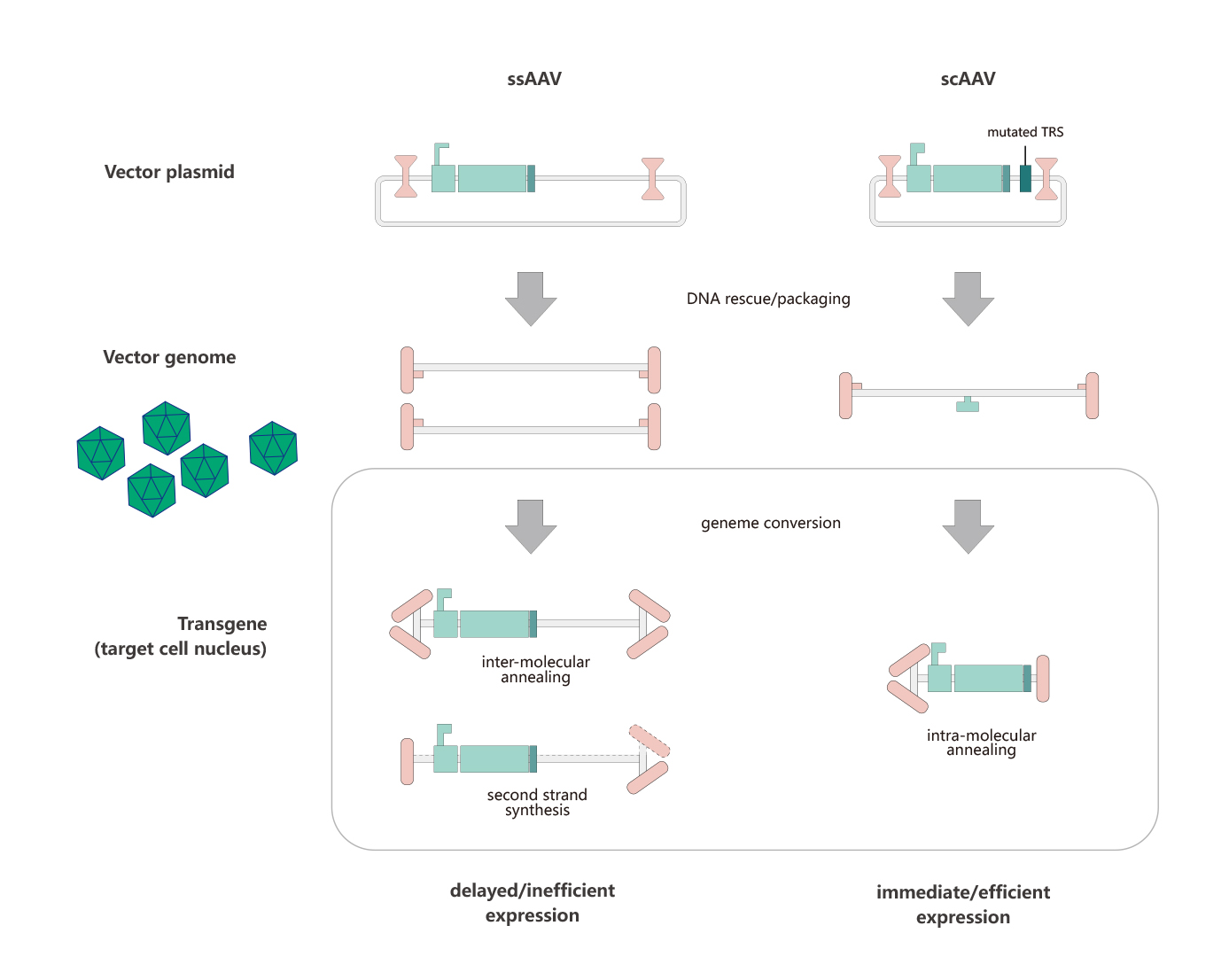
目前,研究人员常用的两类AAV分别为single-stranded AAV (ssAAV) and self-complementary AAV (scAAV)。scAAV是基于2个基础被开发的:一个是理论基础:无论scAAV还是rAAV,病毒颗粒中均可包裹二倍体,甚至四倍体的AAV基因组DNA,一个是结构基础:wtAAV ITR序列的特殊性(T型结构,见AAV基因组部分)。ssAAV包装基因组正义链和反义链的几率一样。ssAAV在入核、脱衣壳后,需要借助宿主DNA聚合酶或者分子间退火完成双链转化,才能启动基因转录过程,而scAAV中已存在双链,它入核后即可启动基因转录,跨过了双链转化的步骤,从而实现外源基因的快速表达。下图是ssAAV和scAAV向靶细胞中递送外源基因的过程。
|
↑↑ 点击返回,查看其它部分 ↑↑ |
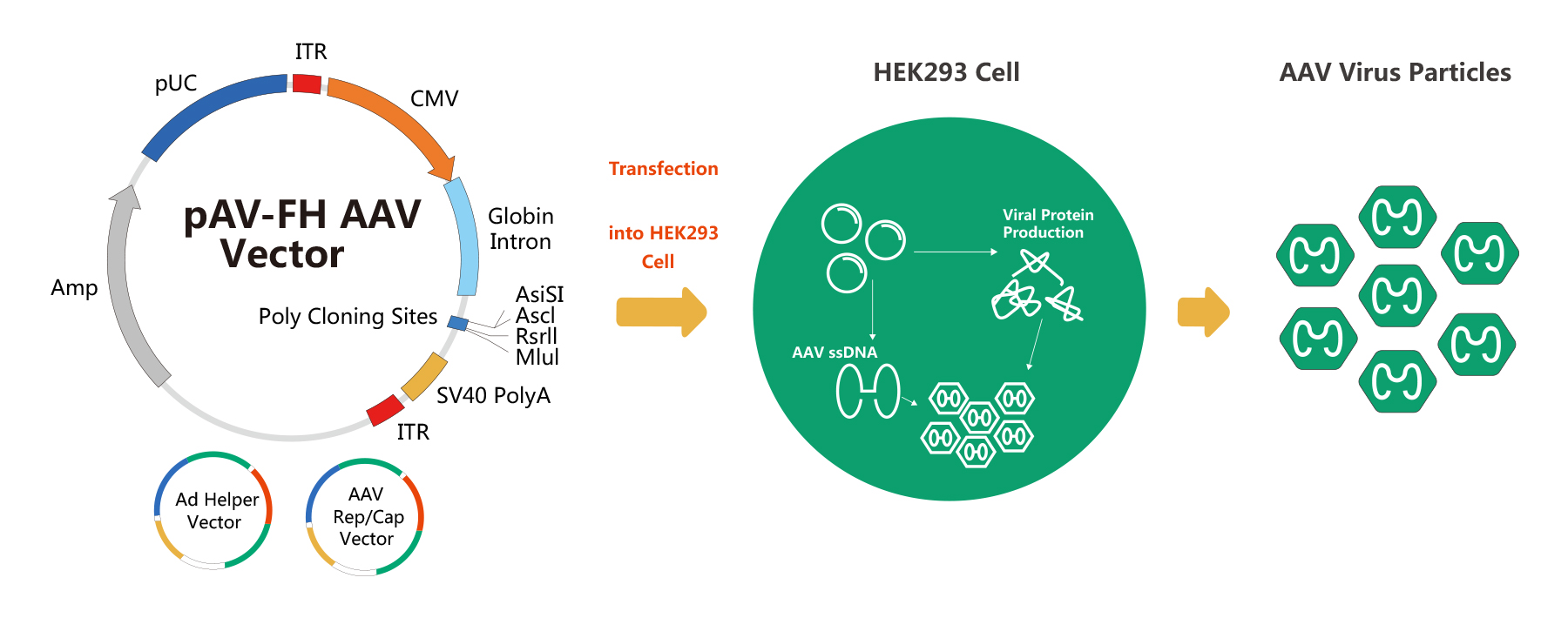
维真生物采用的腺相关病毒/AAV包装系统为改良版的腺相关病毒/AAV无辅助病毒系统(AAV Helper-Free System),下面是该包装系统的示意图:
 |
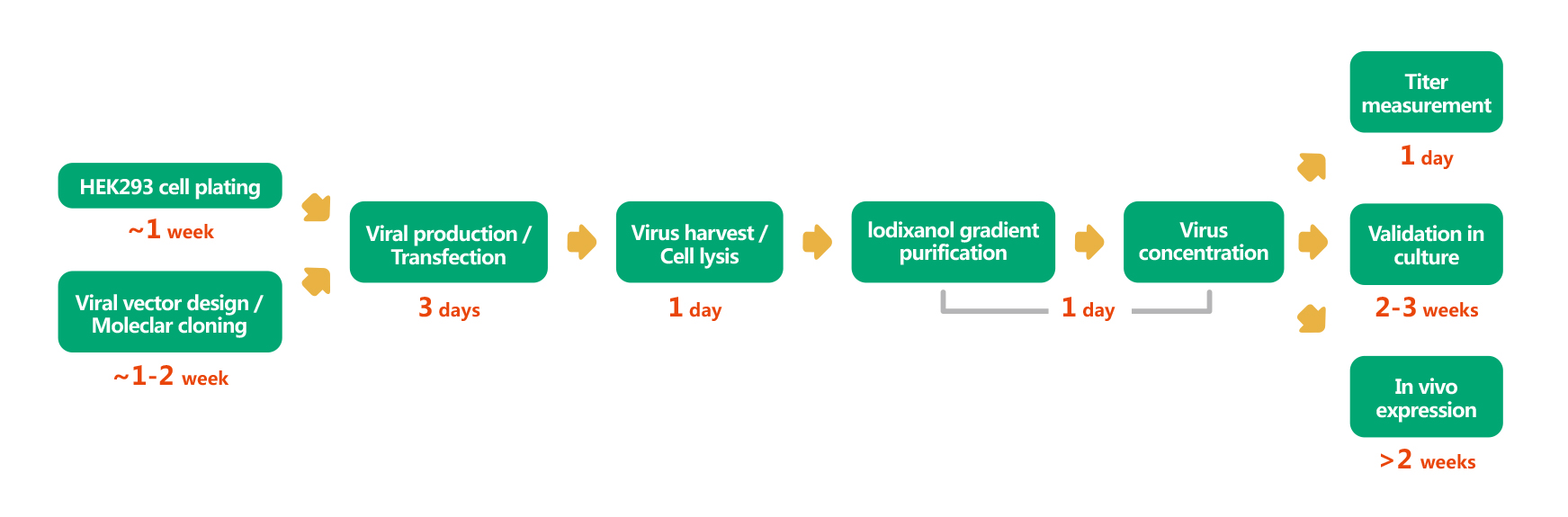
维真生物可以提供从腺相关病毒/AAV质粒设计、构建、包装至表达分析的全套服务。不仅如此,维真生物也可以提供全面的腺相关病毒/AAV载体和表达系统,用于体内和体外表达human/mouse/rat ORFs,lncRNA、circRNA、shRNAs和CRISPR/gRNA。维真生物生产的腺相关病毒/AAV具有滴度高、纯度高和稳定性高的三高优点。下面是腺相关病毒/AAV从头合成的流程:
 |
维真生物采用碘克沙醇密度梯度超速离心法对AAV病毒进行纯化。碘克沙醇是一种造影剂,已接受了临床检验。它具有非离子型、对细胞无毒和代谢惰性等优点。现在在病毒纯化方面应用广泛。它利用不同颗粒之间存在的沉降系数差,在一定离心力作用下,颗粒各自以一定速度沉降,在密度梯度不同区域上形成区带。下图是AAV病毒纯化前后的示意图:
 |
维真生物的AAV病毒是通过用QPCR的方法来检测的病毒滴度,得到的结果为包装得到的病毒颗粒数。其原理是用腺相关病毒基因组特异性引物进行实时定量PCR。在定量曲线的线性范围内,Ct值与已知拷贝数质粒的Ct值的比值即为病毒基因组的初始拷贝数。下面是AAV-GFP滴度的检测结果:
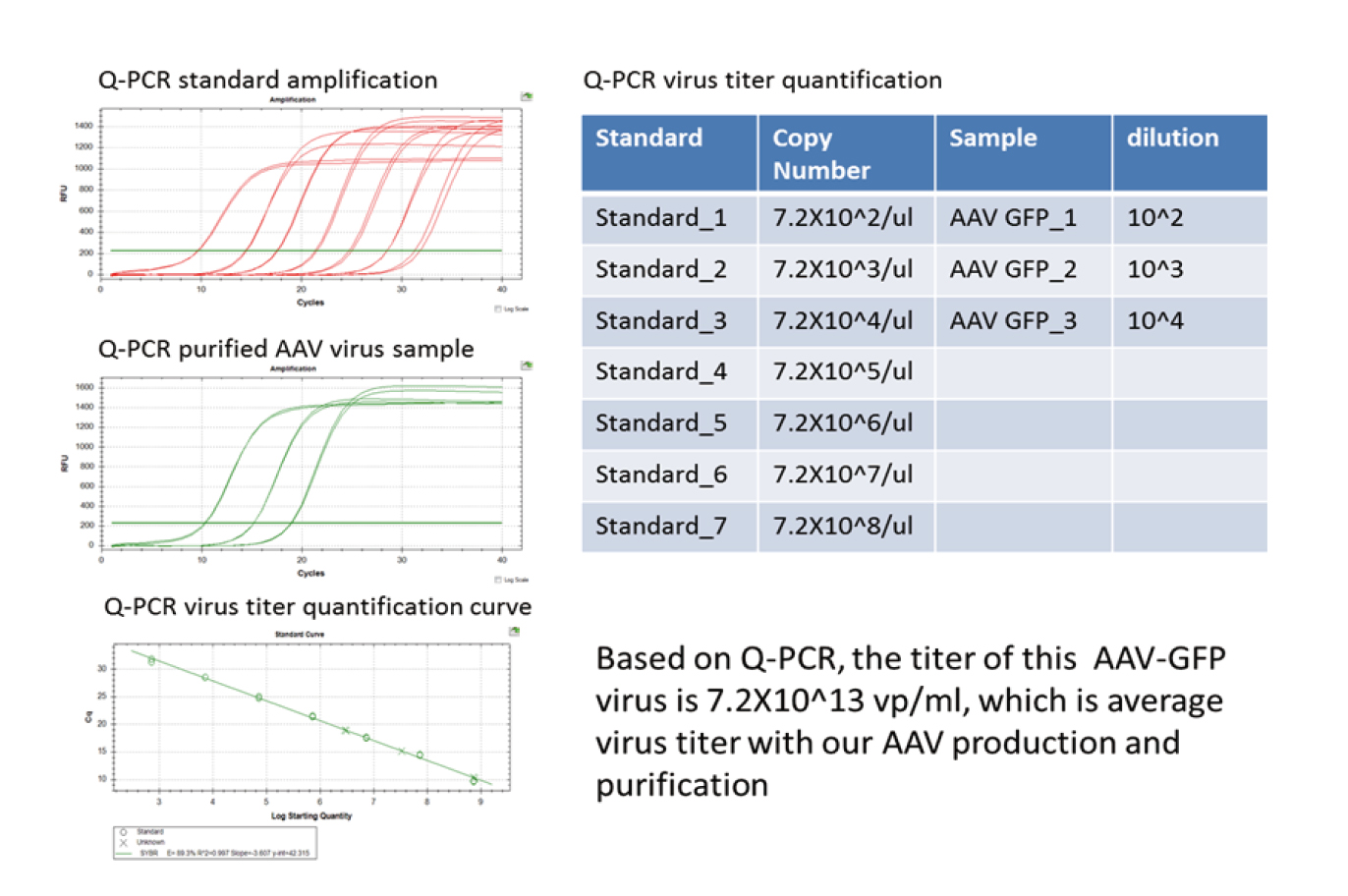 |
维真生物的AAV纯度通过灵敏的银染方法进行检测。AAV衣壳蛋白含有3种亚基VP1(82kDa)、VP2(72kDa)、VP3(62kDa),且所占比例为VP1:VP2:VP3=1:1:10。因此,一个纯度高的AAV在SDS-PAGE分析时仅显示三条带。下图是纯化后AAVs的银染结果:
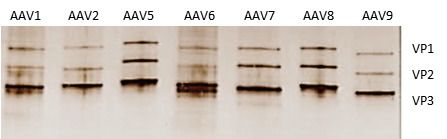 |
|
↑↑ 点击返回,查看其它部分 ↑↑ |
|
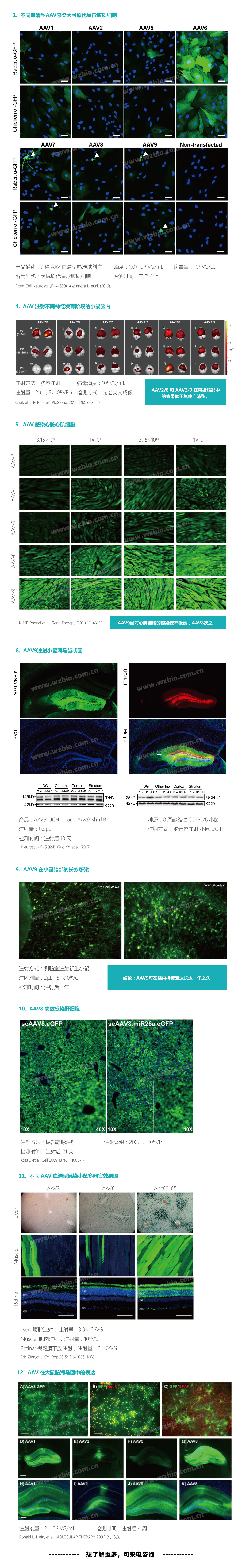
1. 载体全: |
近30多种组织特异性启动子和多种报告基因可供客户选择。 |
|
2. 货期短: |
AAV克隆载体均与我们18,000个预制人源ORF cDNA克隆MCS区通用,行业中生产周期短; |
|
3. 滴度高: |
可提供1012V.G/ml及以上滴度的病毒.可高达1014V.G/ml; |
|
4. 服务优: |
可根据客户具体实验,由公司专业技术人员提供载体构建方案,提供特殊定制服务。 |
 |
1. AAV 和重组rAAV的区别?
腺相关病毒(AAV)属于微小病毒科,是一类小的、二十面体、无包膜病毒。1965年,AAV发现于腺病毒制备物中,并由此得名。AAV是一种复制缺陷性病毒,其复制依赖于其他辅助病毒,如腺病毒和疱疹病毒。AAV不编码自己的聚合酶,因此其复制过程依赖于宿主细胞的聚合酶活性。
重组AAV(rAAV)是人工改造的AAV,没有编码AAV病毒复制和结构蛋白的rep和cap基因。rAAV中与复制和包装相关的rep和cap 基因被替换为ITRs间的基因表达框,这使rAAV具有约4.7 kb的包装容量。
2. 使用AAV有哪些生物安全性要求 ?
可在生物安全1级(BSL-1)实验室操作生产无辅助病毒和编码非致癌基因的重组AAV。另外,应在生物安全2级(BSL-2)实验室封闭处理具有生物危害性的材料。
3. 重组AAV 安全吗 ?
迄今为止,未发现野生型AAV有致病性。野生型AAV,在无需辅助病毒(如腺病毒)的存在下,复制效率非常低。重组腺相关病毒(rAAV)由多个质粒(cis质粒、辅助质粒、rep/Cap质粒)组成。Cis质粒、辅助质粒与rep/Cap质粒之间不具有同源性序列,因此重组AAV在理论上不具有复制的能力。
4. 哪些血清型的AAV可供选择?
目前为您提供的AAV 血清型为AAV1,AAV2,AAV5,AAV6,AAV7,AAV8 &,AAV9,AAV rh10,AAV retro,AAV ANC80,AAV DJ & AAV DJ-8,AAV PhpB & AAV PhpeB,AAV 7m8和AAV shh10等。
5. 使用重组腺相关病毒rAAV递送基因的优势是什么 ?
rAAV病毒滴度高,可感染分裂和非分裂细胞、免疫原性小、体内表达外源基因时间长。
6. AAV载体稳定吗? 如何保存AAV载体 ?
纯化的AAV载体在4℃或更低温度下高度稳定。建议您将AAV分装后,-80℃下长期保存。
7. 订制AAV服务,客户需要提供哪些材料? 客户收到的产品是怎样的 ?
您可以从我们的人源ORF cDNA库中挑选,或者提供您的质粒DNA或DNA序列,我们将基因克隆至AAV载体。您还可以指定特定的融合标签和AAV血清型。
基因沉默服务,请您提供已验证的shRNA序列以构建重组rAAV载体。我们的标准载体具有U6启动子和GFP标记。
通常情况下,可为客户提供500 ul病毒液1×10^13 VP/ml。也可根据客户的需要,提供特定规格的产品。
8. 慢病毒、腺病毒、腺相关病毒三种病毒有什么区别?如何选择?
对于转染困难的细胞,科研工作者通常会选择病毒来导入目的基因。目前,腺病毒、慢病毒和腺相关病毒是常用的病毒载体工具。那么如何选择适合您实验体系的病毒工具,请参考下面3种病毒工具的比较:
|
病毒表达系统 |
腺病毒 |
腺相关病毒 |
慢病毒 |
|
病毒基因组 |
dsDNA |
ssDNA |
ssRNA |
|
病毒外壳 |
无 |
无 |
具有包膜蛋白 |
|
基因组大小 |
38-39kb |
5kb |
9kb |
|
包装容量 |
7.5kb |
4.7kb |
6kb |
|
感染的细胞类型 |
分裂细胞和非分裂细胞 |
分裂细胞和非分裂细胞 |
分裂细胞和非分裂细胞 |
|
整合至宿主基因组 |
非整合 |
非整合 |
整合 |
|
表达丰度 |
高水平表达 |
高水平表达 |
中到高水平表达 |
|
表达时间 |
快(1-2天) |
1-2周(体内) |
慢(2-4天) |
|
外源基因持续表达时间 |
短暂 |
潜在的持久 |
长久 |
|
免疫反应 |
较高 |
极低 |
低 |
|
相对病毒滴度 |
10E10pfu/mL |
10E13VG/mL |
10E8TU/mL |
|
生物安全等级 |
BSL-2 |
BSL-2 |
BSL-2 |
|
↑↑ 点击返回,查看其它部分 ↑↑ |
神经方面:
|
1. |
||
|
2. |
||
|
3. |
||
|
4. |
||
|
5. |
||
|
6. |
||
|
7. |
||
|
8. |
||
|
9. |
||
|
10. |
||
|
11. |
||
|
12. |
||
|
13. |
||
|
14. |
心脏方面:
血管方面:
肝脏方面:
|
1. |
||
|
2. |
||
|
3. |
||
|
4. |
||
|
5. |
||
|
6. |
||
|
7. |
||
|
8. |
||
|
9. |
||
|
10. |
皮肤方面:
|
1. |
肾脏方面:
|
1. |
||
|
2. |
||
|
3. |
||
|
4. |
肺脏方面:
|
1. |
||
|
2. |
体外实验:
|
1. |
巨噬细胞方面:
|
1. |
||
|
2. |
||
|
3. |
||
|
4. |
CAR-T细胞:
|
1. |
|
↑↑ 点击返回,查看其它部分 ↑↑ |