 当前位置:首页 > 新闻中心 > 新闻资讯
当前位置:首页 > 新闻中心 > 新闻资讯
序目
CAR T细胞免疫疗法(Chimeric Antigen Receptor T-Cell Immunotherapy,CAR T)是一种治疗肿瘤的新型精准靶向细胞治疗方法,其基本原理是体外合成识别肿瘤相关抗原的scFv和胞内信号域“免疫受体酪氨酸活化基序(ITAM)”,通过多种方式将其递送至患者自身的T细胞,使患者的T细胞表达肿瘤抗原受体,经过进一步纯化和大量扩增后,将基因工程化的患者T细胞回输给患者,从而实现治疗的目的。

(BioMed Research International, 2010)
2017年,美国食品和药物管理局(FDA)批准了首个CAR T产品Kymriah (tisagenlecleucel),用于治疗25岁以下复发性或难治性B-细胞急性淋巴细胞白血病患者。该技术在血液恶性肿瘤的治疗中显示出了良好的抗肿瘤效应。但是由于实体瘤的异质性及肿瘤微环境(tumor microenvironment,TME)的免疫抑制作用,CAR T疗法在实体瘤治疗中却极具挑战性。
CAR介绍
嵌合抗原受体(Chimeric Antigen Receptor,CAR)是一种合成的跨膜受体,可以附着在癌细胞的特定蛋白质上,组成成分主要有胞外结构域(抗原结合结构域和铰链)、跨膜结构域和细胞内信号结构域(共刺激区和激活区)。
下图所示为CAR四代结构发展示意图:

肿瘤微环境与巨噬细胞
肿瘤微环境TME是一个动态网络,原发肿瘤部位微环境主要包括肿瘤相关巨噬细胞、肿瘤相关纤维细胞、髓源性抑制细胞、肥大细胞等,这些细胞可分泌多种细胞因子、趋化因子促进肿瘤转移。肿瘤相关巨噬细胞(TAM)是浸润在肿瘤组织周围最多的免疫细胞,TAMs可使肿瘤细胞逃离基底膜的束缚到达周围正常组织基质,促进新生血管形成,新生血管可为肿瘤生长提供营养和氧分,并为肿瘤细胞的转移提供路径。TAMs还可释放一系列直接促进肿瘤细胞浸润和转移的细胞因子及生长因子。

(Reis, E.S., et al. Nat Rev Immunol, 2018. 18(1): p. 5-18.)
根据巨噬细胞的活化类型及其在肿瘤微环境中的不同作用,TAM主要分为M1型和M2型巨噬细胞。M1型巨噬细胞分泌促炎性细胞因子和趋化因子,呈递抗原,参与正向免疫应答,具有抗肿瘤作用。M2型巨噬细胞分泌抑制性细胞因子下调免疫应答,主要发挥促进肿瘤生长、侵袭和转移的作用。肿瘤特定的微环境迫使TAM的表型向着有利于肿瘤发展的方向演变,即M2型TAM的生成。在已知患者的肿瘤中M2型巨噬细胞占据主流,利用CAR生物技术对巨噬细胞进行基因改造,将它们的吞噬活性直接作用于肿瘤,由原来的促进肿瘤发展转为抑制肿瘤发展。
2020年3月美国宾夕法尼亚大学的Klichinsky团队利用CAR T疗法的技术思路建立了CAR M疗法,通过病毒载体将CAR导入巨噬细胞,从体外、体内研究了该技术的抗肿瘤效应。结果显示,CAR M可以杀灭实体瘤细胞。其发表的研究成果见下图:

Klichinsky等人改造的CAR M作用过程示意图如下所示:
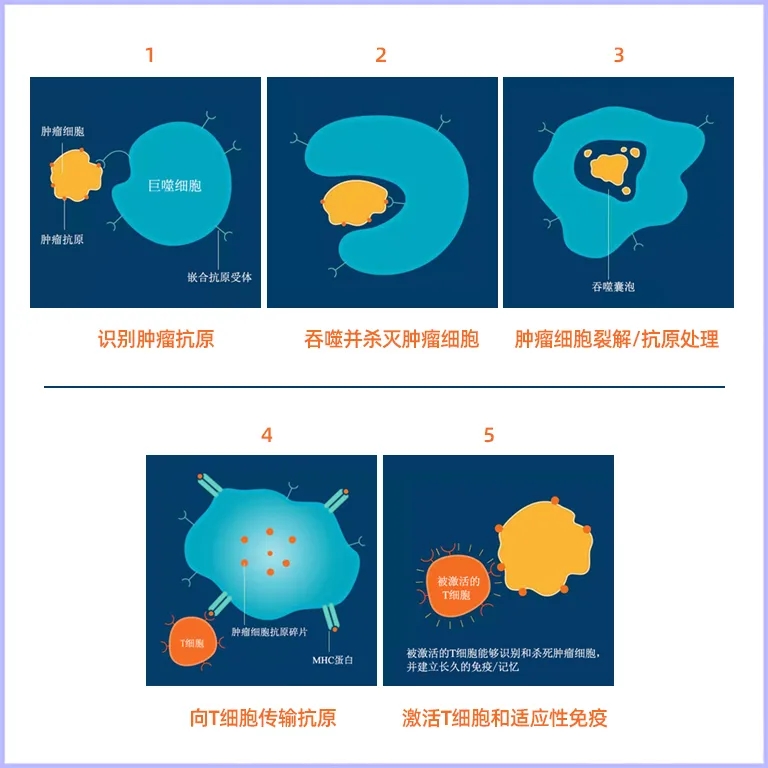
(图片来源于Carisma Therapeutics公司官网)
由于巨噬细胞对病原体具有自然吞噬的特性,这使得人原代巨噬细胞不易被基因操作中常用的病毒载体转染。Klichinsky团队成功使用一种嵌合腺病毒载体----Ad5F35克服了这一困难。Ad5F35是一种嵌合型腺病毒载体,在腺病毒AdV5的基础上,其受体结合位置的纤突改造成F35型腺病毒(F35)的纤突,其细胞受体从CAR变成了CD46(巨噬细胞表达CD46),其基因仍保留AdV5载体的特性,能有效转导CAR表达不足的靶细胞,尤其是对肿瘤细胞、造型干细胞及间充质干细胞有较高的感染效率。Ad5F35将CAR成功地传递到了人原代巨噬细胞,CAR M可靶向吞噬肿瘤细胞,还通过分泌促炎症细胞因子改变肿瘤附近的微环境,将肿瘤抗原呈递给T细胞,激活T细胞对肿瘤的免疫反应,增强对肿瘤的杀伤力!部分实验结果如下图所示:① 荧光显微镜和成像流式细胞术证实了CAR介导的巨噬细胞具有吞噬肿瘤的作用(图1);② CAR M成功靶向实体瘤间皮素(Mesothelin)和HER2(Human epidermal growth factor receptor-2,人类表皮生长因子受体2)抗原,并对实体瘤细胞进行了吞噬(图2);③小鼠异种移植SKOV3(卵巢癌细胞系),通过尾静脉注射和腹腔注射CAR Ms后观察治疗效果,发现CAR Ms均显著降低小鼠的肿瘤负荷,小鼠寿命分别延长35天和65天(图3)。
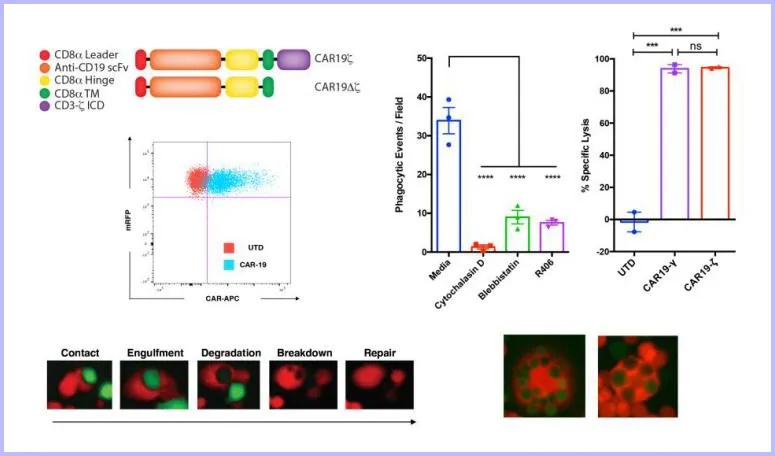
图1
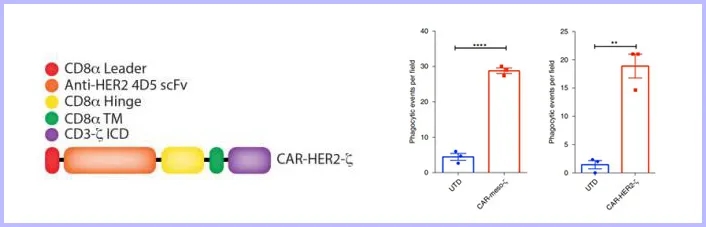
图2
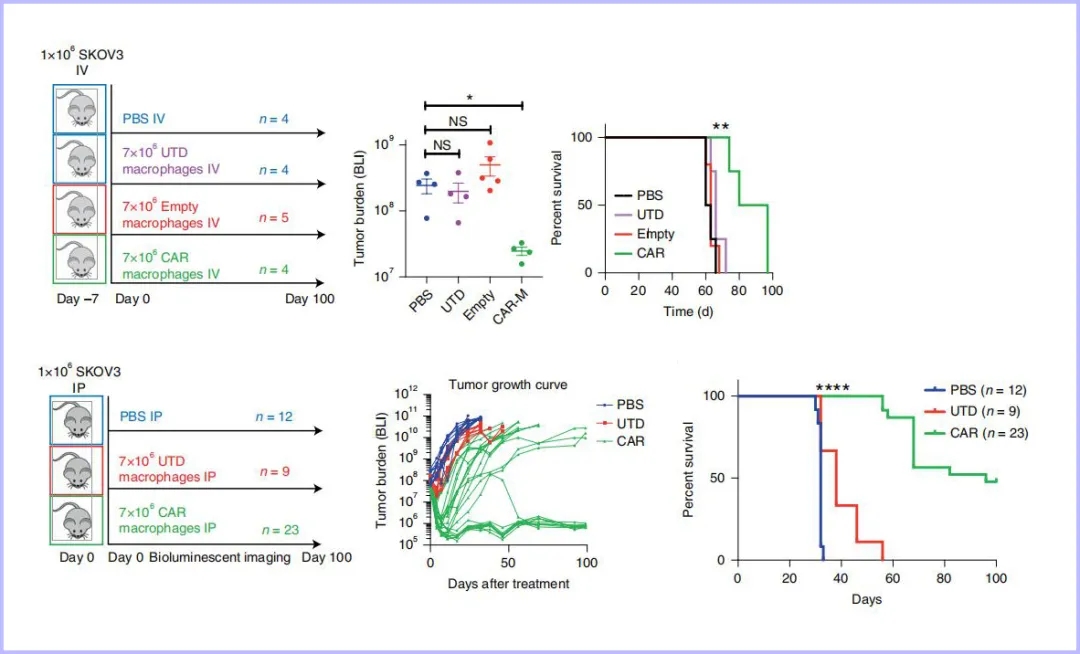
图3
(Klichinsky, M., et al. Nature Biotechnology, 2020.)
科学家已经证明CAR M比CAR T更能有效对抗实体肿瘤,但是将CAR M疗法应用于临床中实体瘤的治疗还要克服很多困难:例如,单核细胞来源的巨噬细胞在体外不增殖,难以大量获得;CAR M 须精准靶向肿瘤中的M2型巨噬细胞等。据报道Carisma Therapeutics 公司将在今年年底启动靶向HER2的CAR-M疗法的I期临床试验,这是CAR M疗法首次进行的临床试验。虽然抗癌之路漫漫其修远兮,但随着对CAR M细胞免疫疗法深入研究,小V相信CAR M细胞疗法或将成为实体肿瘤的杀手锏。
维真生物可为科研者提供CAR载体的改造和构建服务以及相关慢病毒或腺病毒包装服务,欲知详情可拨打热线电话400-077-2566,欢迎您致电垂询!
文献参考
[1]. Klichinsky, M., et al., Human chimeric antigen receptor macrophages for cancer immunotherapy. Nature Biotechnology, 2020.
[2]. Zhou, S., et al., A novel chimeric antigen receptor redirecting T-cell specificity towards CD26(+) cancer cells. Leukemia, 2020.
[3]. Morrissey, M.A., et al., Chimeric antigen receptors that trigger phagocytosis. Elife, 2018. 7:e36688.
[4]. Reis, E.S., et al., Complement in cancer: untangling an intricate relationship. Nat Rev Immunol, 2018. 18(1): p. 5-18.
[5]. Fan, M., et al., Chimeric antigen receptors for adoptive T cell therapy in acute myeloid leukemia. J Hematol Oncol, 2017. 10(1): p. 151.