 当前位置:首页 > 新闻中心 > 新闻资讯
当前位置:首页 > 新闻中心 > 新闻资讯
2020年10月7日,诺贝尔化学奖首次同时颁发给了两位女科学家:法国Emmanuelle Charpentier和美国Jennifer A. Doudna,以表彰她们在“开发基因组编辑方法”方面做出的变革性贡献。
据了解,Emmanuelle Charpentier首先在细菌化脓性链球菌中发现了tracrRNA;2011年指出了tracrRNA是细菌古老免疫系统CRISPR/Cas的一部分;同年,Emmanuelle Charpentier和Jennifer A. Doudna合作;2012年她们发表的论文中指出Cas9蛋白是双RNA引导的DNA内切酶,并首次在体外证明使用Cas9的CRISPR系统可以切割任意DNA链。同时,她们简化了基因剪刀的分子成分,创建了CRISPR/Cas9基因剪刀,使其更易于使用。后来,她们又用CRISPR/Cas9基因剪刀成功编辑了大肠杆菌的基因,证明了CRISPR/Cas9比其它类型的基因剪刀更有效和准确。
Emmanuelle Charpentier和Jennifer A. Doudna的研究成果为CRISPR/Cas9技术的发展做出了核心贡献。
CRISPR/Cas系统是细菌和古细菌在长期演化过程中形成的一种适应性免疫防御,可用来对抗入侵的病毒及外源DNA。CRISPR主要有两类:第1类(包括第I、III、IV型)利用多种Cas蛋白,而第2类(第II、V、VI型)则需要单一Cas蛋白。这些Cas蛋白利用RNA引导靶向切断并降解外来入侵DNA。哺乳动物细胞中常用的用于基因编辑的Cas酶包括II型化脓性链球菌(Sp)Cas9、略小的金黄色葡萄球菌(Sa) Cas9或V型Cas12a / Cpf1。在II型CRISPR系统中,crRNA与反式激活tracrRNA形成复合物(称向导RNA,gRNA),靶向Cas9蛋白从而切断DNA中的特定位点。
在哺乳动物细胞基因编辑应用中,gRNA中包含了一个与基因组DNA靶点互补(附近有一个前间区序列邻近基序,简称PAM)的20 bp序列,它将Cas9蛋白定位到该位点,从而在DNA中产生双链断裂(DSB)。Cas9蛋白切割后产生的DSB主要通过两种机制进行修复:一种是细胞内源性的非同源端连接修复机制(NHEJ),可以导致小的插入或删除(indels),或通过同源定向修复(HDR),添加外源性模板,产生新的DNA。(图一)
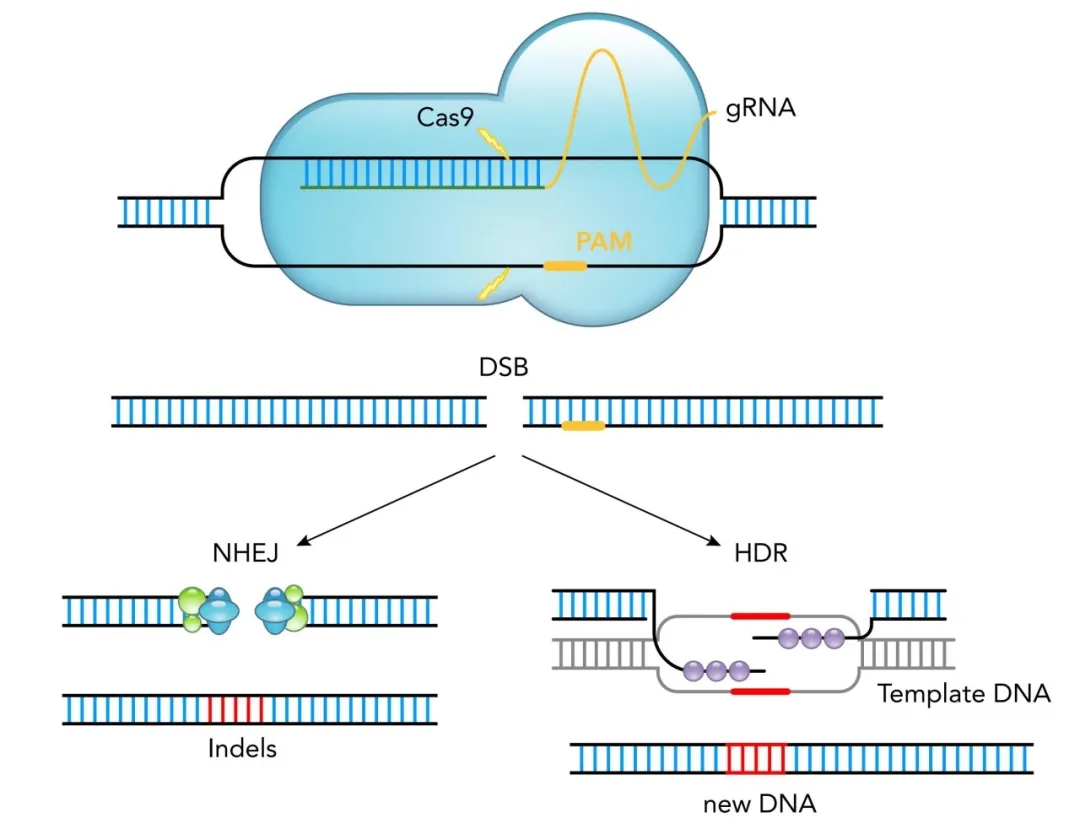
1. spCas9 和 saCas9
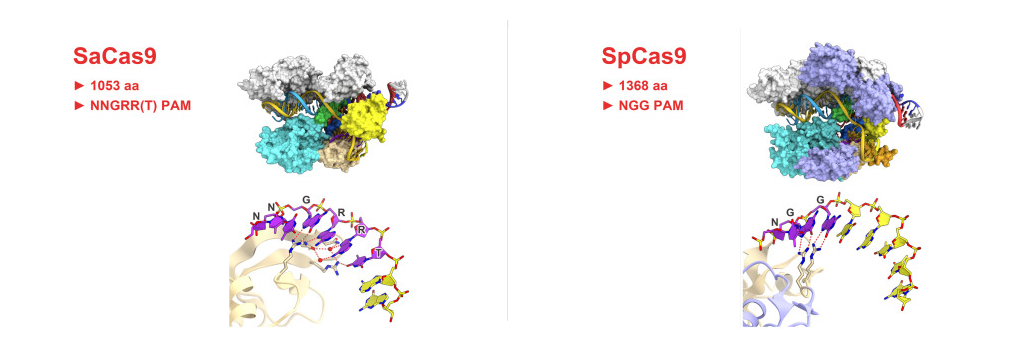
根据PAM序列的不同,Cas9分为spCas9和saCas9两种。(图二)
saCas9基因序列长约3.3kb,spCas9基因序列长约4.1kb,由于saCas9的基因序列要比spCas9的基因序列短很多,所以在克隆方面,saCas9要更为容易,且saCas9更适宜包装成AAV病毒,两者也都可以包装成腺病毒和慢病毒。saCas9和spCas9另外一个很大的区别是两者识别的PAM序列不同,saCas9识别的PAM序列是5’-NNGRRT-3’,而spCas9识别的PAM序列为5’-NGG-3’,因为saCas9的PAM序列要比spCas9的PAM序列长,在基因组中出现的概率更低,相比于spCas9脱靶率要低,其gRNA设计也相对更困难。
2. CRISPR/Cas9与ZFN和TALENs的比较
CRISPR/Cas9是继ZFN和TALENs之后的第三代基因编辑技术。与前两代基因编辑技术相比,CRISPR/Cas9具有低成本、高效率和简单易用等优势,因而被人们广泛应用。下表所列为ZFN、TALENs和CRISPR/Cas9三种基因编辑技术的比较。
| 特性 | ZFN | TALENs | CRISPR/ Cas9 |
|---|---|---|---|
| 序列识别组分 | 蛋白-DNA | 蛋白-DNA | RNA-DNA |
| 靶向效率 | 特异性和效率低 | 特异性和效率较低 | 特异性和效率高 |
| 成本效率 | 成本高 | 成本较高 | 成本低 |
| 脱靶诱变 | 可变的 | 低 | 中等的 |
| 设计参数 | 蛋白 | 蛋白 | RNA |
| 病毒传递 | 容易 | 中等 | 中等 |
3. CRISPR /Cas9技术的应用
①基因功能筛选
利用慢病毒载体中建立单一的gRNA文库并应用于哺乳动物细胞的基因功能分析,与现有的RNA干扰文库比较,除了产生敲除而不是暂时敲除外,也降低了脱靶效应。 ②为诊断和基因治疗创建细胞和动物模型
CRISPR/Cas9技术可精确地修改细胞和动物模型中的DNA,可能从单点突变到染色体易位,从而导致转基因细胞系和动物系统的产生。这一应用不仅对诊断有效,而且对错误插入或缺失的纠正也有效,从而成为基因治疗的一个重要方面。
③抗菌及抗病毒药物应用
研究表明,通过噬菌体传递针对细菌耐药基因设计的CRISPR/ Cas9系统,有助于靶向耐药候选菌。类似地,序列特异性抗病毒药物也在开发中,可利用CRISPR/ Cas9技术修饰参与宿主-病毒相互作用的基因。
④在植物中的应用
CRISPR/Cas9系统为植物基础研究提供了宝贵的工具,也为作物改良提供了机会。CRISPR/Cas9系统可以很容易地对普通作物进行改造,有望成为植物育种的发展方向。水稻、小麦、玉米、番茄、苹果、模范豆科植物、荷花、苜蓿等均已成功转化。
|
①gRNA现货质粒 • 13000余个小鼠gRNA pool克隆和350余个人源gRNA pool克隆; • 针对每个基因设计多条gRNAs,敲除概率大; • 人源gRNA pool克隆均经过敲除效果验证,效果有保障; • 交货时间短,次日发货; • 现货供应。 |
小鼠和人源gRNA克隆所用质粒 |
②敲除细胞系
•160余种人源基因HEK293敲除细胞系;
•人源基因HEK293敲除细胞系比瞬时敲除效率更高,时间更长,效果更好;
•交货时间短,敲除细胞系2周发货;
维真生物可为科研工作者提供全套CRISPR/Cas9相关服务,包括gRNA的设计与筛选、gRNA/Cas9载体构建、gRNA/Cas9病毒包装、敲除效果验证以及KO细胞系的建立。
1. 服务项目全:维真生物可以提供从gRNA序列设计、gRNA质粒构建、高效gRNA序列筛选、病毒包装和细胞系建立等多种灵活性服务,满足科研工作者不同的实验需求;
2. 服务种类多:维真生物可以提供单gRNA质粒构建,多合1 gRNA质粒构建和gRNA pool & gRNA mix质粒构建;
①4 gRNA mix质粒构建—— 保证有效 & 选择性多
该服务是将4条gRNA序列克隆至Cas9 + gRNA all in one慢病毒质粒。该重组质粒不仅可以用于转染细胞,也可包装成慢病毒。但是,考虑到重组载体比较大对细胞转录效率的影响,我们强烈推荐您直接选择慢病毒成品。
②gRNA pool质粒构建—— 编辑效率大大提高
维真生物采用特殊的生产工艺针对同一基因构建gRNA pool质粒,大大提高了目的基因的编辑效率。
3. 质粒数量多:维真生物可以提供单载体、双载体;腺病毒载体、慢病毒载体和AAV 载体;不同报告基因EGFP和RFP,不同真核抗性筛选基因puro和Blat、cre功能基因质粒。
| 腺病毒载体 | |
|---|---|
|

|
|
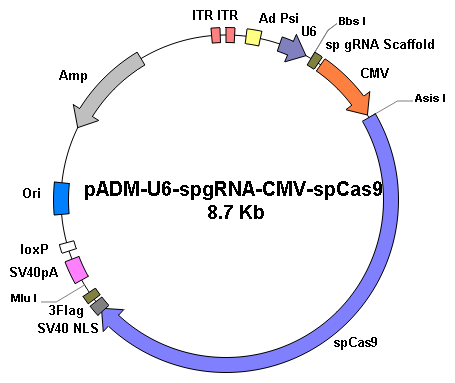
|
| …… | |
| 慢病毒载体 | |
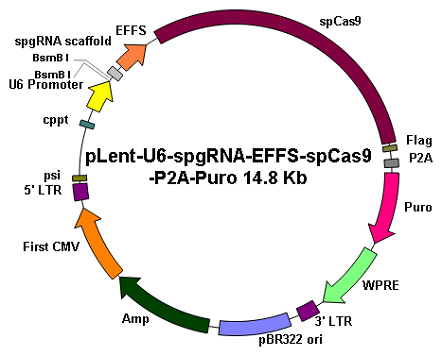
|
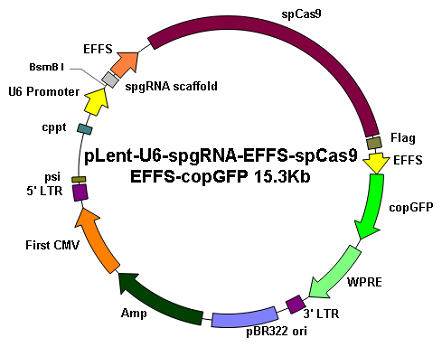
|
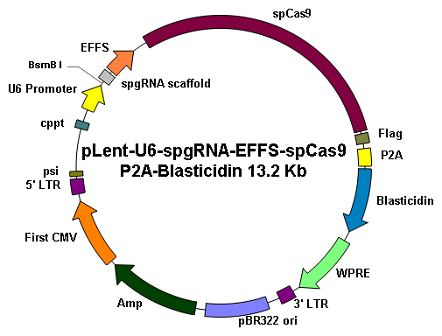
|
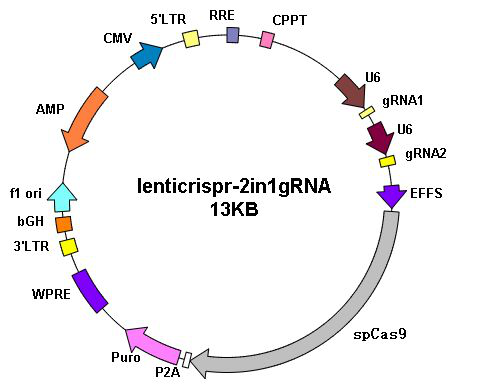
|
| …… | |
| AAV载体 | |
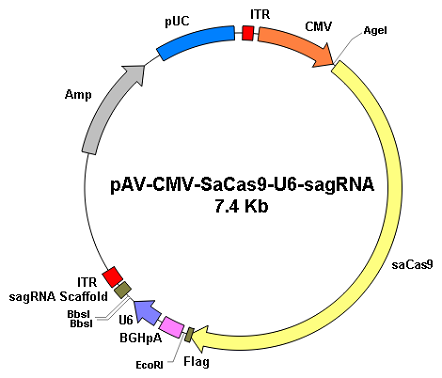
|
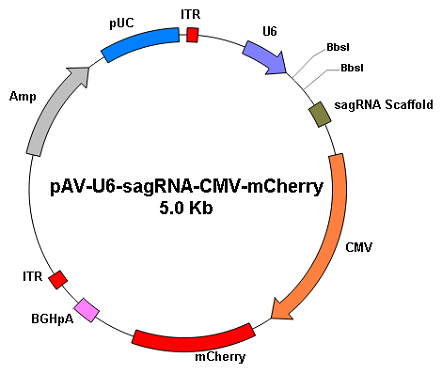
|
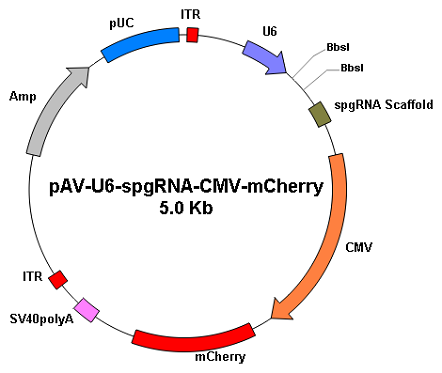
|
|
| …… | |
4. 效果有保障:
维真生物建立了一套简捷和可重复的基因敲除效果检测系统——荧光法,克服了常规检测方法的弊端,操作简单、周期短、敲除效果检测不受细胞类型的限制、实验结果直观可靠!
设计策略如下:
咨询更多CRISPR/Cas9相关产品和服务请拨打技术热线电话400-077-2566。
参考文献:
[1]. Young, C.S., A.D. Pyle and M.J. Spencer, CRISPR for Neuromuscular Disorders: Gene Editing and Beyond. Physiology (Bethesda), 2019. 34(5): p. 341-353.
[2]. Gupta, D., et al., CRISPR-Cas9 system: A new-fangled dawn in gene editing. Life Sci, 2019. 232: p. 116636.
客户代表性文献:
1. Science Advances. (IF=13.116). Sun, et.al. (2020). Development of a CRISPR-SaCas9 system for projection- and function-specific gene editing in the rat brain.[北京大学 CRISPR-saCas9 基因编辑雄性SD大鼠特定神经元群];
2. Int. J. Mol. Sci. (IF=4.556). Xu, et al. (2020). Effective MSTN Gene Knockout by AdV-Delivered CRISPR/Cas9 in Postnatal Chick Leg Muscle.[上海交通大学 AdV-CRISPR system(pAdM-U6-gRNA1-U6-gRNA2-CMV-spCas9) 鸡胚成纤维细胞DF-1 MOI=1000 & 鸡肌肉注射 鸡骨骼肌的生长和发育];
3. Retrovirology. (IF=4.183). Wang, et.al. (2017). Genome modifcation of CXCR4 by Staphylococcus aureus Cas9 renders cells resistance to HIV-1 infection.[武汉大学基础医学院 AAV-SaCas9-CXCR4-gRNA HIV基因治疗]。