IF12.2|石河子大学医学院牛强/Mulatibieke Keerman研究团队揭示F-53B诱导神经毒性的新机制
6:2氯代多氟醚基磺酸(F-53B)作为全氟辛烷磺酸(perfluorooctane sulfonate,PFOS)的替代品,广泛存在于各种自然环境中。F-53B被认为具有神经毒性,但其作用机制尚不清楚。2025年1月4日,石河子大学医学院牛强/Mulatibieke Keerman研究团队在Journal of Hazardous Materials (IF12.2) 发表题为“F-53B disrupts energy metabolism by inhibiting the V-ATPase-AMPK axis in neuronal cells”的研究论文,文章阐明了F-53B通过V-ATPase-AMPK轴诱导神经毒性的新机制,并表明V-ATPase和AMPK是潜在的治疗靶点。

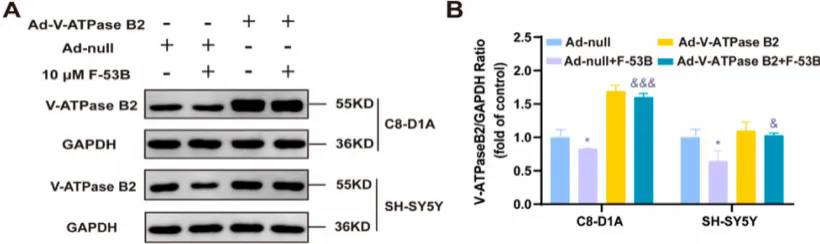
Ad-V-ATPase B2干预后C8-D1A和SH-SY5Y细胞中V-ATPase B2表达显著增加
研究结果
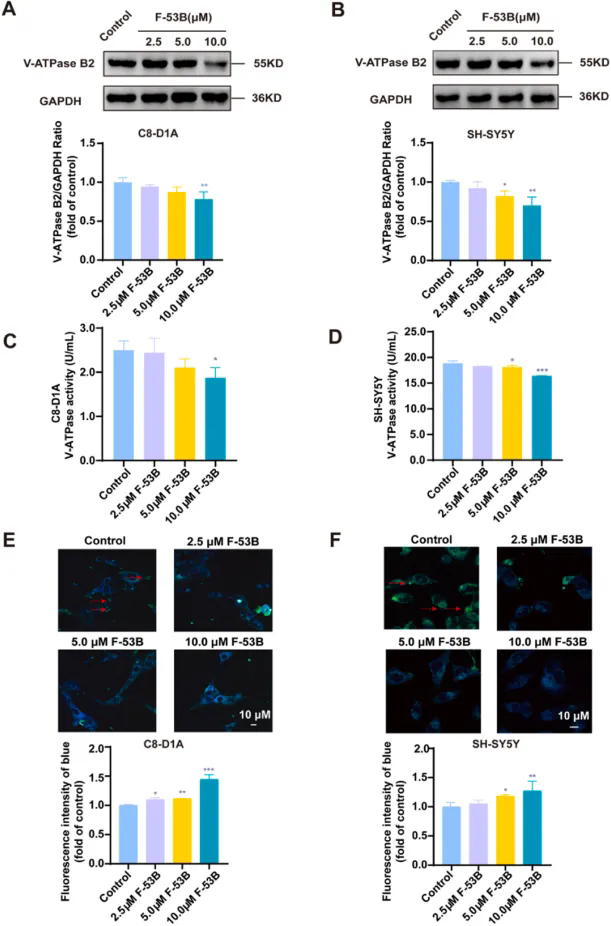
1.F-53B抑制神经元细胞中V-ATPase B2表达和V-ATPase活性,损伤线粒体功能
通过免疫荧光法测量线粒体ROS含量和线粒体膜电位(MMP)的变化,发现与对照组相比,F-53B暴露损害线粒体功能并降低神经元细胞中的ATP水平。与对照组相比,F-53B暴露抑制了C8-D1A和SH-SY5Y细胞中p-AMPK的表达,随着F-53B剂量的增加,PFKFB3和NDUFS1蛋白的表达水平也显著降低,进一步分析了两种细胞系中的CI活性,发现暴露于10.0μM F-53B显著抑制了CI活性。Western blot分析显示,F-53B显著抑制了C8-D1A和SH-SY5Y细胞中V-ATPase B2的表达并降低V-ATP酶活性。此外,经F-53B处理的细胞溶酶体pH值升高。进一步的分析表明,F-53B暴露以剂量依赖的方式显著抑制了C8-D1A和SH-SY5Y细胞中TRPML1和CaMKK2蛋白的表达,并增加了细胞溶酶体中的Ca2+积累。
F-53B暴露增加溶酶体pH值,抑制神经元细胞中V-ATPase B2表达和V-ATPase活性
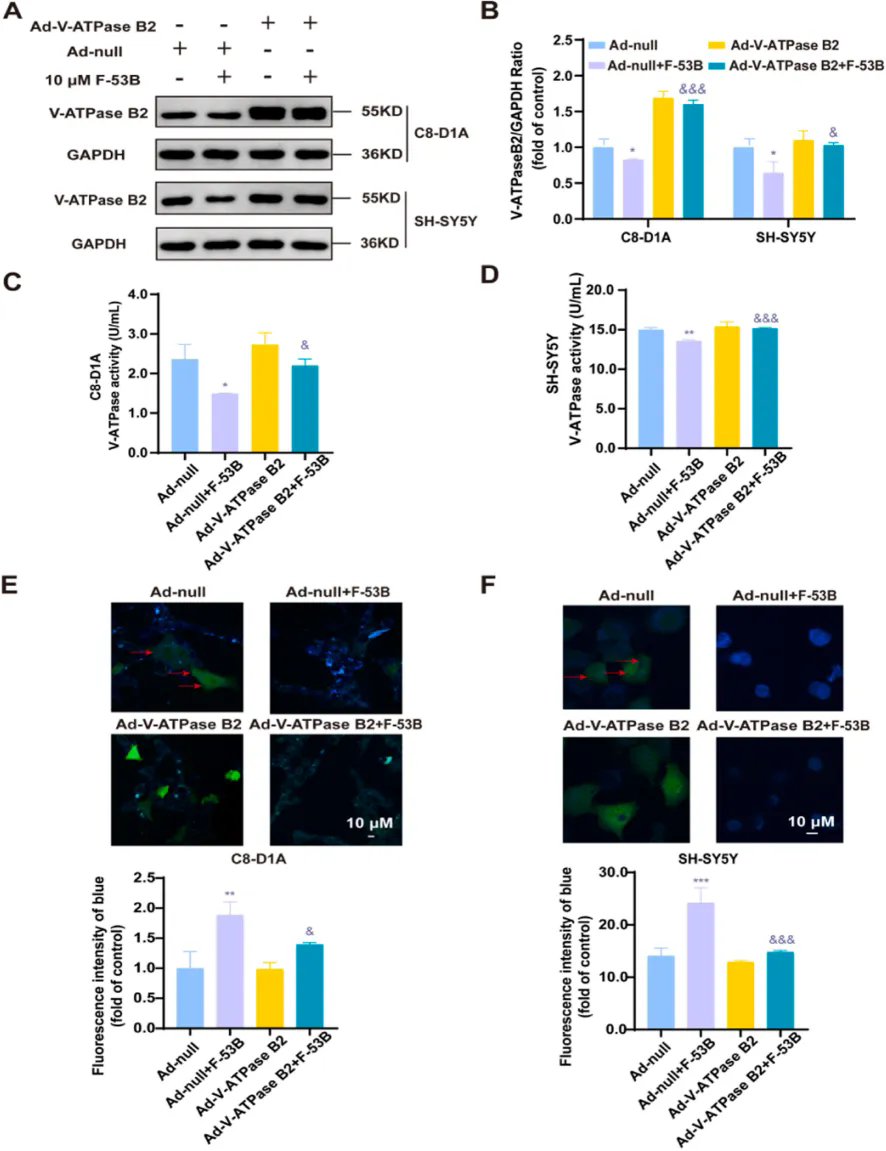
2.V-ATPase B2过表达可减轻F-53B诱导的能量代谢损伤
研究团队利用腺病毒载体在C8-D1A和SH-SY5Y细胞中过表达V-ATPase B2,以验证V-ATPase B2的上调能否抵消F-53B引起的上述损害。结果显示,Ad-V-ATPase B2+F-53B联合治疗组V-ATPase B2表达增加,V-ATP酶活性显著升高;V-ATPase B2的过表达有效地恢复了F-53B诱导的溶酶体pH值升高。此外,联合治疗组TRPML1表达明显增加、溶酶体Ca2+积累减少、CaMKK2和p-AMPK蛋白表达及ATP水平均显著升高,表明V-ATPase B2的过表达减轻了F-53B引起的能量代谢损伤。进一步研究证明呼吸道合胞病毒可缓解F-53B诱导的p-AMPK表达抑制及线粒体损伤,恢复神经元细胞中的能量代谢途径。
V-ATPase B2过表达恢复了F-53B诱导的V-ATPase B1表达和V-ATPase活性的降低,并缓解了神经元细胞溶酶体pH值的升高
研究结论
本研究结果表明,F-53B抑制V-ATPase活性,升高溶酶体pH值,导致溶酶体Ca2+积累,随后通过降低CaMKK2表达阻断p-AMPK及其下游信号通路的表达。这种调节机制破坏了V-ATPase-AMPK信号轴,导致神经元细胞严重的能量代谢功能障碍,并减少了ATP的产生。值得注意的是,Ad-V-ATPase B2和RSV的干预显著减轻了F-53B诱导的神经细胞毒性。这些发现为F-53B的神经毒性机制提供了新的见解,并为未来旨在调节V-ATPase-AMPK信号轴的神经保护策略提供了潜在的靶点。
 当前位置:首页 > 新闻中心 > 新闻资讯
当前位置:首页 > 新闻中心 > 新闻资讯