 当前位置:首页 > 新闻中心 > 新闻资讯
当前位置:首页 > 新闻中心 > 新闻资讯
近日,香港理工大学李建华教授团队通过建立索拉非尼耐药的HCC(肝细胞癌)患者源性的肿瘤异种移植模型(PDTXs),探究HCC对索拉非尼的获得性耐药机制,发现EPHB2激酶在其中起到极其关键的作用,该研究确定了一个EPHB2/β-catenin/TCF1的正反馈环,可调节肝癌的肿瘤干性和对索拉非尼的耐药性,提示靶向该反馈环可能是对抗HCC获得性耐药的一种可行的治疗策略。

肝细胞癌(Hepatocellular carcinoma, HCC)是全球常见的恶性肿瘤之一,晚期患者居多且治疗效果差、复发率高。2007年索拉非尼获得FDA批准,成为HCC第一种全身性治疗药物,改善了HCC晚期患者的生存率。然而,由于HCC对索拉非尼的耐药性,生存率并不是十分乐观。因此,深入了解HCC对索拉非尼的耐药机制尤为重要。先前的研究证明,对索拉非尼耐药的HCC中肿瘤干细胞(CSC)的干细胞特性会增强,靶向介导肝CSCs特性的信号通路可能是逆转HCC耐药的一种策略。
首先,研究者通过建立对索拉非尼耐药的HCC患者源性的肿瘤异种移植模型(PDTXs),确定了研究靶点——耐药肝癌细胞系中上调最显著的激酶EPHB2。经测序及定量分析发现,肝脏CSCs标志物在PDTXs中显著上调,且肝癌组织中EPHB2的表达明显高于正常及肝纤维化组织,提示EPHB2的致癌性。为研究EPHB2在肝癌中的促肿瘤作用,研究者在免疫活性小鼠中进行内源EPHB2的敲除,发现内源性EPHB2敲除后肿瘤结节的大小和数量显著减少,且小鼠的存活时间更长。然后研究者进行了EPHB2过表达和敲除,证实EPHB2表达升高促进了成瘤,肝脏CSCs的标志物表达增加,药物处理效果较差,而敲除EPHB2后得到与上述相反的结果。接着,研究者探寻上下游效应因子,通过一系列体内外实验,最终确定了一个可以调节肿瘤干性与耐药性的EPHB2/β-catenin/TCF1正反馈环。
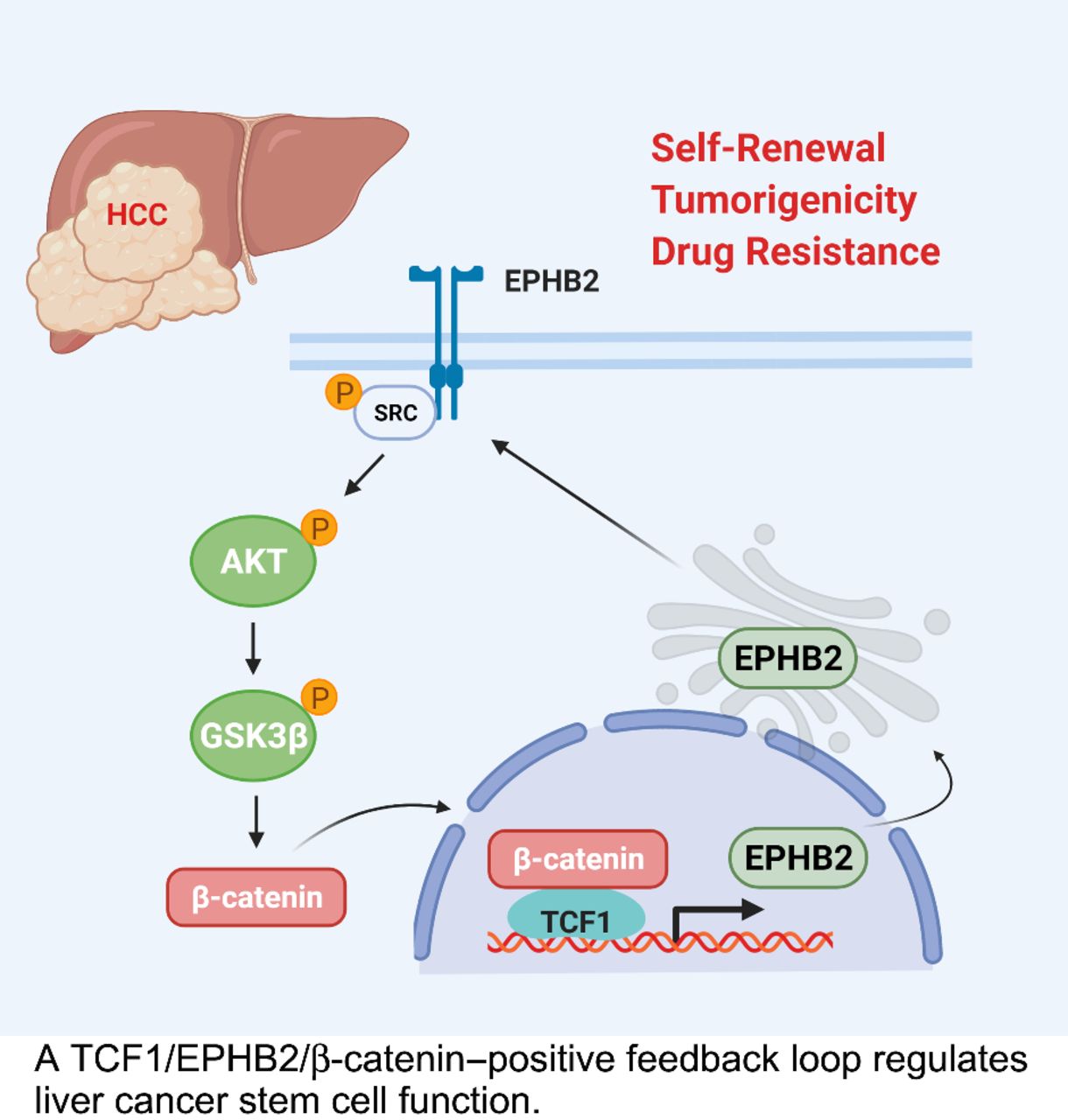

该篇研究之初,研究者证实了EPHB2在索拉非尼耐药的HCC细胞中表达升高,并有促肿瘤的作用,能促进HCC肿瘤生长,参与调节肝细胞癌的CSC特性和耐药性。那么,EPHB2的下游效应因子是什么,其发挥作用的机制又是如何?研究者马上又进行了下一步的探讨。
RNA测序分析显示HCC肿瘤细胞(PLC/PRF/5)中EPHB2表达降低后,Wnt/β-catenin信号通路中60%以上的相关基因发生了显著改变。为证实这一点,研究者探究了EPHB2突变对β-catenin反式激活活性的影响,发现当EPHB2被抑制时,β-catenin的反式激活活性被抑制且蛋白表达量降低,EPHB2过表达的细胞则相反。此外,免疫沉淀发现,EPHB2能磷酸化SRC激酶,当EPHB2被过表达或抑制时,SRC的磷酸化会发生改变,进而导致AKT/GSK3β/β-catenin信号通路的变化。此外,TCGA分析结果也显示Wnt/β-catenin信号通路是EPHB2高表达的HCC患者中唯一显著富集的通路。以上结果共同证实,Wnt/β-catenin是EPHB2的主要信号因子。
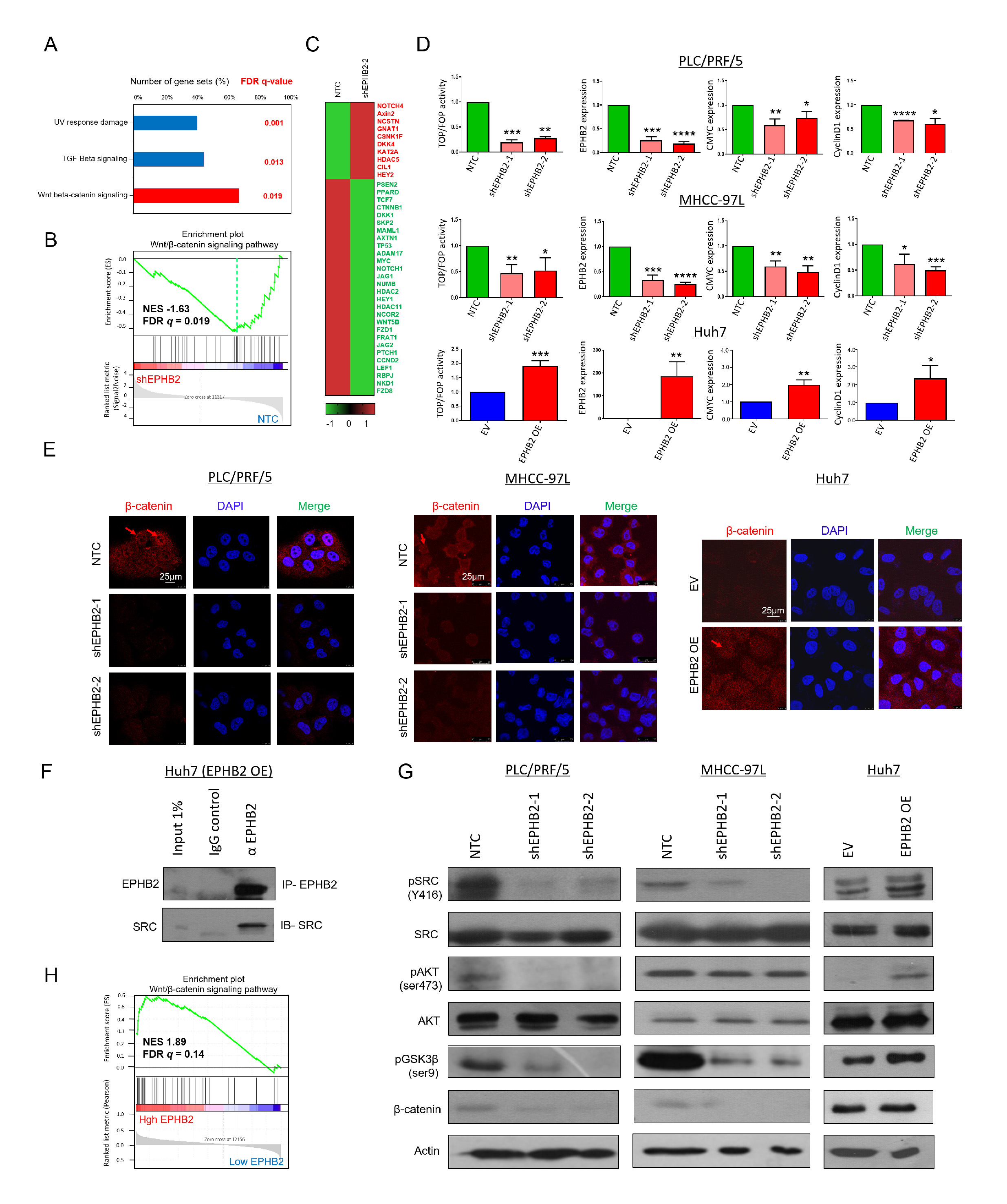
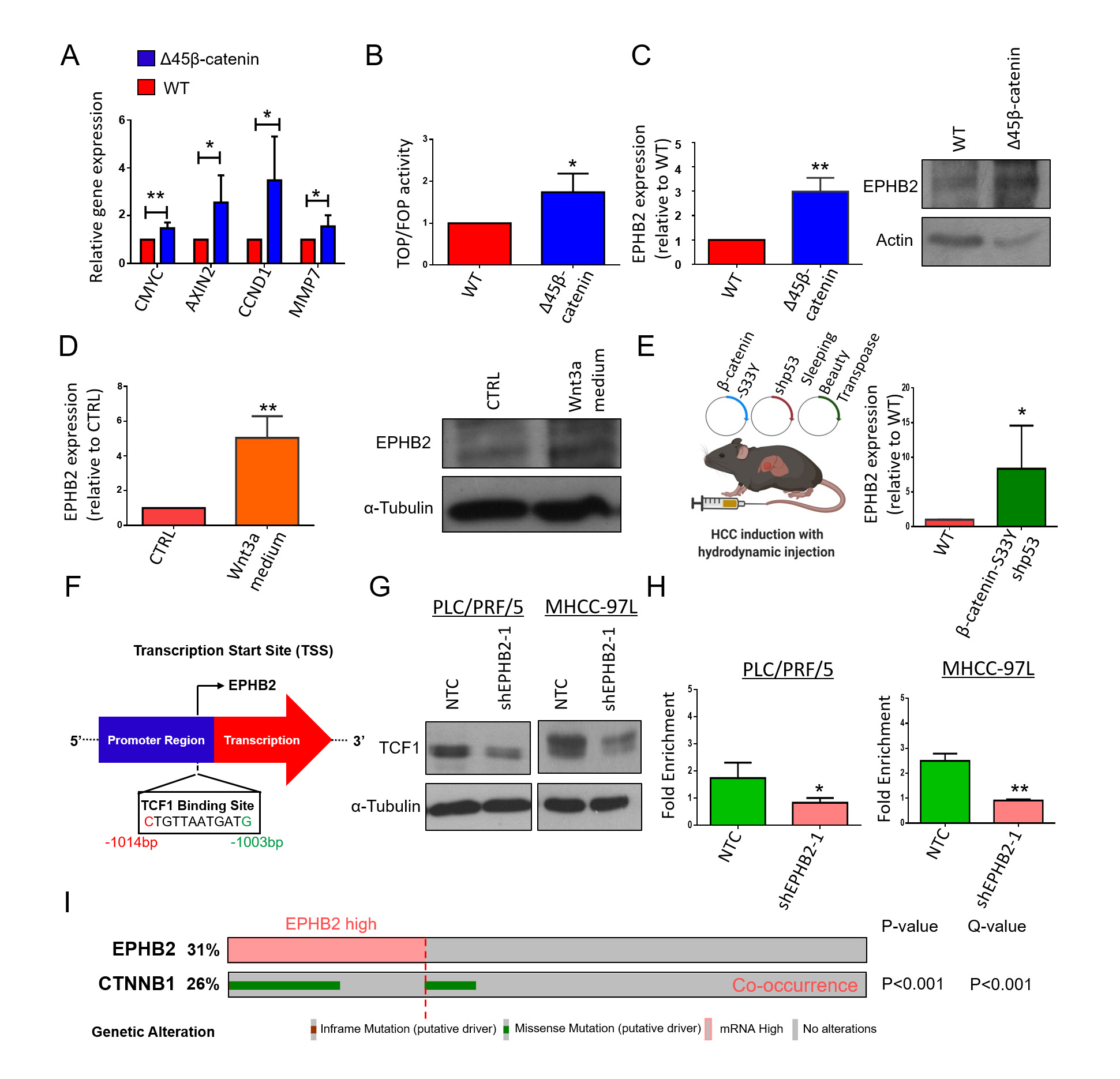
已知在结直肠癌中EPHB2是Wnt的靶基因,但具体调节机制尚不清楚。研究者通过体内外实验激活Wnt/β-catenin通路,发现EPHB2的表达水平均呈现持续上调,推测Wnt/β-catenin在转录水平激活了EPHB2的表达,后通过生物信息学的方法预测到EPHB2上游存在一个可能的TCF1(T细胞因子)结合位点,β-catenin可入核与TCF1结合促进EPHB2的转录表达,形成一个正反馈回路。
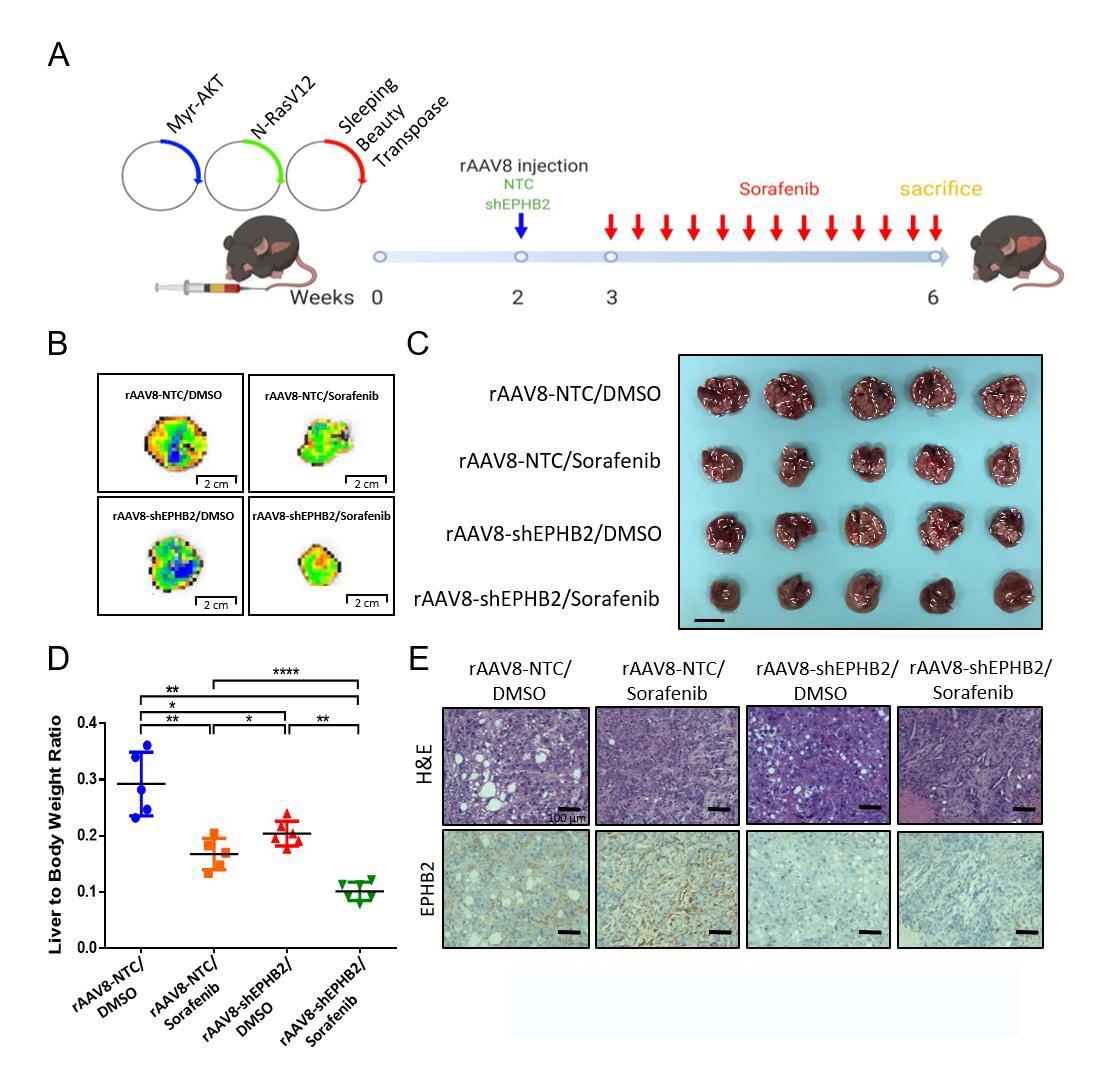
最后,研究者通过敲低EPHB2表达并联合索拉非尼探究EPHB2体内治疗的靶向性。在NRAS/ akt诱导肝癌小鼠模型两周后,通过静脉注射rAAV8-shEPHB2(维真生物荣幸提供)抑制EPHB2的表达,并在一周后给予小鼠30mg /kg的索拉非尼治疗21天(DMSO作为对照药物)。通过计算实验组与对照组小鼠的肝重/体重比,研究者发现rAAV8- shEPHB2联合索拉非尼对肿瘤生长有明显的抑制作用,说明降低EPHB2表达并联合索拉非尼协同治疗能有效抑制体内HCC的发生。
综上所述,该研究证明EPHB2通过TCF1/EPHB2/β-catenin正反馈环来调节肿瘤的干性和耐药性。靶向EPHB2或与其他靶点联合治疗肝癌可能是一种新的治疗策略。
备案号:鲁ICP备13011878号 网址:www.wzbio.com.cn









