 当前位置:首页 > 新闻中心 > 新闻资讯
当前位置:首页 > 新闻中心 > 新闻资讯
近日,中国医学科学院阜外医院陈敬洲教授团队在《Theranostics》上发表了题为“Lysyl hydroxylase 1 (LH1) deficiency promotes angiotensin II (Ang II)–induced dissecting abdominal aortic aneurysm”的研究成果,文章揭示了赖氨酸羟化酶1(LH1)在夹层型腹主动脉瘤(AAA)中的作用——LH1缺失导致血小板反应蛋白1(Thbs1)上调进而引发促炎反应、增加基质金属蛋白酶(MMP)活性及严重的血管平滑肌细胞(VSMCs)凋亡,最终导致夹层型AAA的形成。此外,研究人员还证实基于腺相关病毒的基因治疗恢复LH1的表达可有效减轻夹层型AAA的发生率及破裂率,保护腹主动脉结构及功能。该研究为LH1在夹层型AAA中的关键作用提供了新的见解,提示LH1可能成为夹层型AAA治疗的潜在干预靶点。
| 维真生物AAV病毒产品为本研究助力! | |
|---|---|
| 病毒产品 | AAV9-LH1-P2A-GFP & AAV9-GFP |
| 病毒剂量 | 2*10E11VG/mice |
| 注射体积 | 200μl |
| 注射方式 | 腹腔注射 |
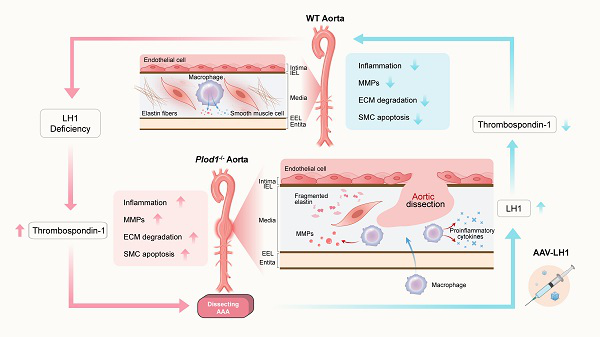
腹主动脉瘤(AAA)是发生在主动脉壁内的与年龄相关的血管疾病,如不及时治疗,将导致腹主动脉的瘤样扩张,并发展为危及生命的主动脉破裂。探究导致AAA血管病变的分子和细胞机制,将为新治疗方法的发展提供新的见解。已知细胞外基质(ECM)蛋白的进行性破坏,特别是早期弹性蛋白碎裂后胶原纤维组织异常,是导致夹层型AAA发病的关键,而赖氨酸羟化酶1(LH1)是I/III型胶原分子间交联和稳定所必需的。然而,LH1在夹层型AAA中的作用尚不明确。
首先,本研究构建了LH1缺失(Plod1−/−)的小鼠模型,并通过Ang II给药诱导夹层型AAA小鼠模型,发现LH1缺失可加重Ang II诱导的夹层型AAA的发生。接着,利用全转录组分析发现LH1缺失导致主动脉中血小板反应蛋白1表达显著升高,使用TAX2多肽靶向血小板反应蛋白1可强烈抑制促炎过程、MMP活性和VSMCs凋亡,降低夹层型AAA的发生率。最后,利用AAV载体恢复了Plod1−/−小鼠中LH1蛋白的表达,发现LH1的表达恢复可以促使血小板反应蛋白1的表达水平降低,并减轻夹层型AAA的形成。此外,在临床AAA患者标本中也一致发现LH1表达的降低与血小板反应蛋白1水平升高相关。
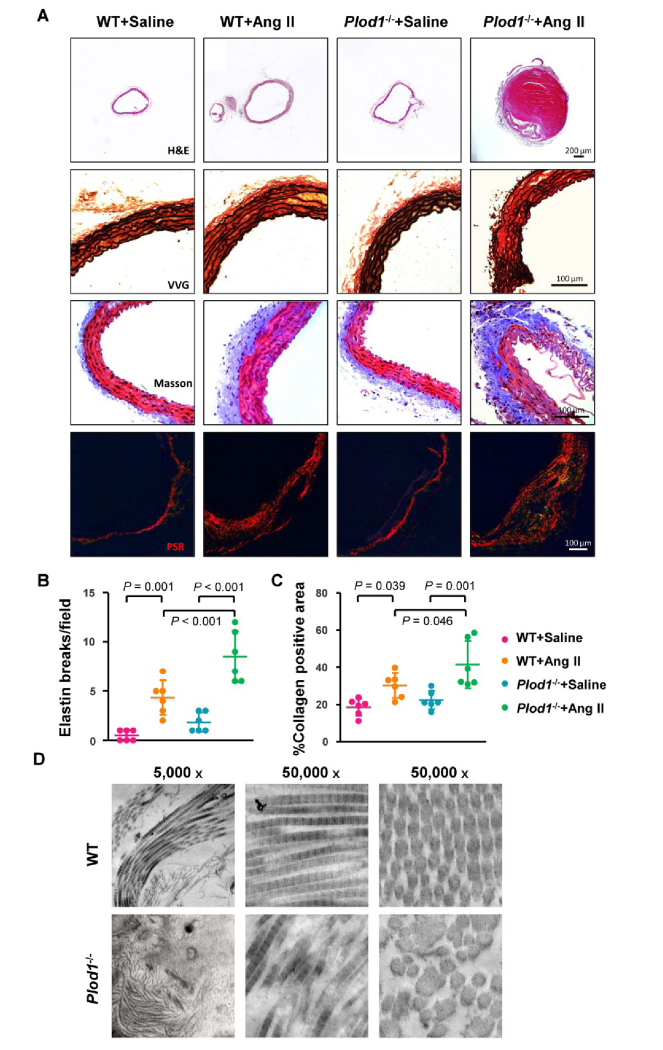
为研究LH1在AAA发病机制中的作用,研究人员构建了LH1缺失(Plod1−/−)小鼠,并通过给予WT和Plod1−/−小鼠血管紧张素II(Ang II),诱导夹层型AAA小鼠模型。对主动脉进行观察发现,与对照组小鼠相比,LH1缺失的小鼠夹层型AAA的发生率和破裂率均显著升高,且其腹主动脉直径也逐渐增大,进一步研究发现Plod1−/−小鼠主动脉硬度显著升高而扩张度明显降低。此外,Ang II给药后,WT小鼠腹主动脉LH1蛋白水平显著升高,由此猜测LH1的缺乏增加了夹层AAA发生和破裂率。研究表明,高血压是AAA的一个发病因素,而血压测量结果表明LH1的缺失并未影响小鼠的血压变化。总的来说,以上数据表明LH1缺失加重了Ang II诱导的夹层型AAA,但不改变高血压反应。

通过对Plod1−/−小鼠腹主动脉的多方面观察,研究人员发现Ang II给药后,Plod1−/−小鼠腹主动脉扩张增加,出现主动脉夹层;弹性蛋白层碎片增加;外膜胶原沉积过多,主动脉纤维化加重。透射电子显微镜检查也证实Plod1−/−小鼠主动脉胶原纤维结构发生异常。这些数据表明LH1缺失增加了Ang II给药对主动脉的结构性损伤,导致夹层型AAA的形成。
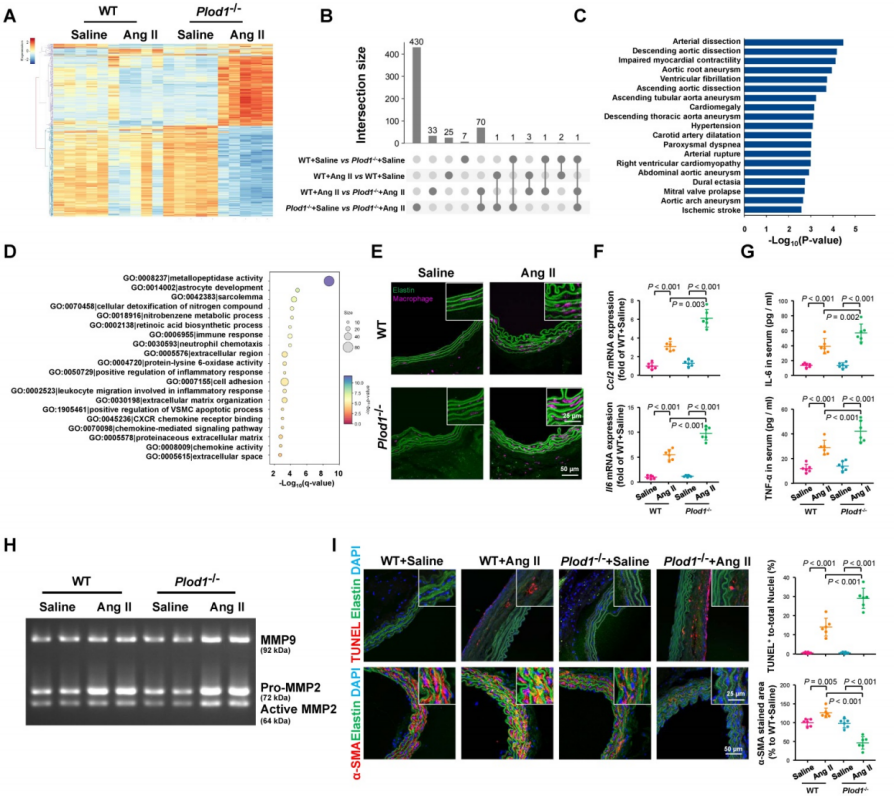
通过对Ang II处理的WT鼠和Plod1−/−鼠腹主动脉组织的RNA测序以及对DEGs分析,研究人员发现DEGs涉及金属肽酶、炎症反应及细胞粘附和血管相关平滑肌细胞凋亡调控因子等多个类别,提示夹层型AAA机制可能涉及促炎、MMP激活和VSMC凋亡过程。免疫荧光染色显示Ang II给药后,Plod1−/−小鼠主动脉中巨噬细胞聚集程度明显增大,促炎因子表达水平升高。使用明胶酶谱法评估MMP的活性,发现Plod1−/−小鼠腹主动脉中MMP活性增加。此外,由MMP介导的VSMC凋亡程度也明显增加。这些数据表明LH1的缺失可以促进炎症反应的发生,激活MMP的活性并能促进腹主动脉血管平滑肌细胞的凋亡。
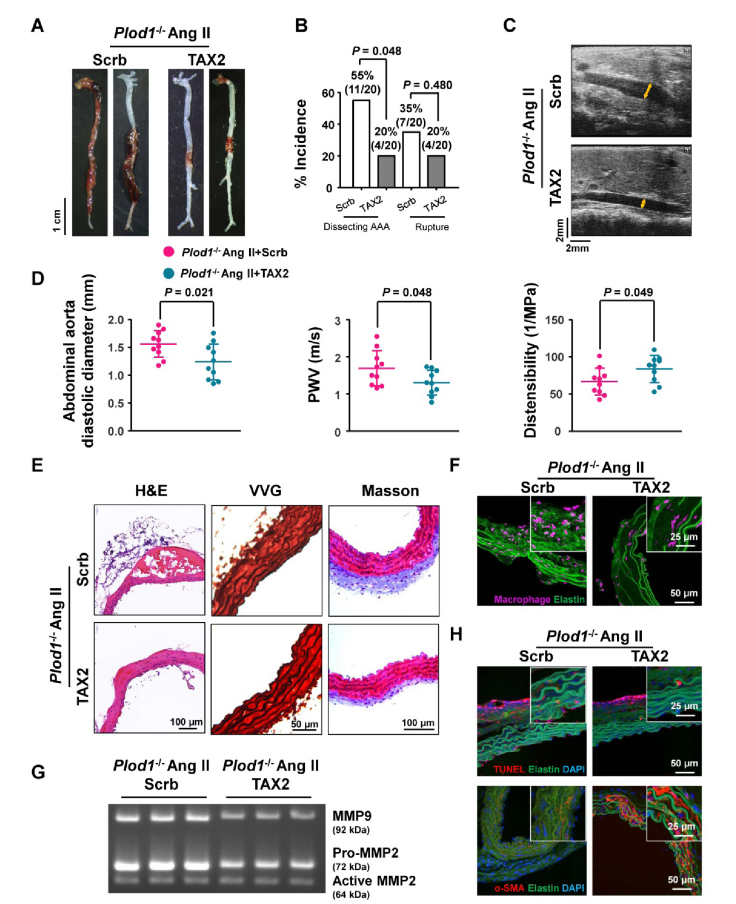
通过对促炎过程、MMP活性和VSMC凋亡的信号通路靶向研究,研究人员发现Ang II给药后Plod1−/−小鼠中血小板反应蛋白1(Thbs1)表达显著升高。使用TAX2多肽处理后,Plod1−/−小鼠中夹层AAA的发生率及破裂率均显著降低,弹性蛋白碎裂和外膜胶原沉积也相应减少。此外,TAX2处理还减弱了Plod1−/−小鼠的主动脉巨噬细胞的积聚,抑制了MMP活性和VSMC凋亡。这些结果表明,LH1缺失后夹层AAA的发病机制可能主要由Thbs1介导。
为了进一步阐明LH1是否在抑制夹层型 AAA 形成中发挥作用,研究者将携带LH1的AAV载体通过腹腔注射入Plod1−/−小鼠中,3周后检测LH1表达发现,注射AAV-LH1的Plod1−/−小鼠腹主动脉中LH1表达得到显著恢复,且Ang II给药14天后血小板反应蛋白1的水平显著降低,表明LH1可能作为血小板反应蛋白1的负调控因子发挥作用。进一步观察发现AAV-LH1的治疗显著抑制了Ang II给药后夹层AAA的形成和破裂,同时减少了弹性蛋白的断裂和外膜胶原沉积,并使胶原纤维结构恢复正常化。综上,通过AAV载体恢复Plod1−/−小鼠中LH1的表达,极大地降低了Ang II诱导的夹层型AAA的发生和破裂,并有效保护了主动脉的结构和功能。

综上所述,本研究首次揭示了LH1在Ang II诱导的夹层型AAA中的作用机制。LH1的缺失导致血小板反应蛋白1表达增加,触发促炎过程,导致MMP 活性增加和严重的VSMCs 凋亡,诱导夹层型AAA的发生。通过AAV介导的体内基因治疗恢复LH1的表达,可以有效降低夹层型AAA的发生及破裂率。本研究提出LH1/血小板反应蛋白1可能是AAA疾病新的潜在治疗靶点,为开辟AAA疾病治疗方法提供了新的思路。