腺病毒-PB转座系统
众所周知,慢病毒载体作为基因传递的工具很大一个优势就是具有整合特性,非常适合构建稳转细胞株,但包装容量小、病毒滴度低也是限制它大显身手的弊端所在,因此只适合常规基因,而无法实现较大基因的稳转株构建。而AAV虽然是体内研究的理想载体,但由于载体容量等原因也无法实现较大基因在体内的长期稳定表达。因此,开发一种新的基因传递工具对于较大基因的体内外研究至关重要。
腺病毒包装容量大,几乎能感染所有类型的细胞,容易制得高滴度的病毒,而且非常适合体内外研究,因此利用腺病毒来制备稳转株并实现基因在体内的长期稳定表达,可能是开发这一新型工具的重要突破口。然而,腺病毒感染细胞只能实现基因的瞬时表达,单从这一点考虑,恐难实现。如何才能发挥其长处,弥补其短板,是需要攻克的难点。
Gene delivery
这不,最近小编听说,腺病毒已经“拓展业务”跑来做稳转株了,这是怎么回事儿?原来,腺病毒深化了对外交往,与PiggyBac(PB)转座子开展了合作。我们知道,PB转座子是研究基因功能,制备转基因动物及基因治疗的优良载体,具有广泛宿主谱,通过“剪切-粘贴”机制介导外源基因的稳定整合与表达。但其目前应用的主要方式仍是通过质粒转染,而质粒载体本身存在转导效率低、非整合等弊端。因此,本次腺病毒与PB的合作将是值得万众期待的。
腺病毒与PiggyBac(PB)强强联合
一、转座子系统介绍
转座子又称跳跃因子,是基因组中一段可移动的DNA序列,它们可以直接从基因组的一个位点“跳跃”到另一个位点,转座子发生位置转移的过程即为转座。转座子载体系统转座时可携带一段外源DNA序列,从而实现目的基因的转移。根据转座机制的不同,可将转座子分为两大类:逆转录转座子和DNA转座子。逆转录转座子以RNA为媒介进行转座,采用“复制-粘贴”机制,即先将自身DNA转录形成RNA中间产物, 再逆转录产生新的DNA拷贝,最后插入基因组的其他位置实现转座, 而原位点的转座子保持不变。DNA转座子则以DNA为媒介进行转座,采用“剪切-粘贴”转座机制,在转座酶的作用下, 转座子从原位置切除下来并整合到新的位点。DNA转座子相对逆转录转座子而言,转座效率高,易被人为改造,因而应用较为广泛,其具体转座机制如图1。
图1. DNA转座子转座机制示意图
野生型的DNA转座子中通常含有转座酶编码序列,转座酶通过识别转座子两端的ITR(反向末端重复序列),介导转座子发生转移。经人工改造后,中间的转座酶编码序列可被其它外源DNA序列所替换,在细胞中转座酶存在的情况下发生转座,从而将外源DNA插入基因组中,实现转基因操作。
图2. DNA转座子实现转基因操作的机制示意图
A:野生型DNA转座子 B:人工修饰的转座子载体 C:转座酶表达载体
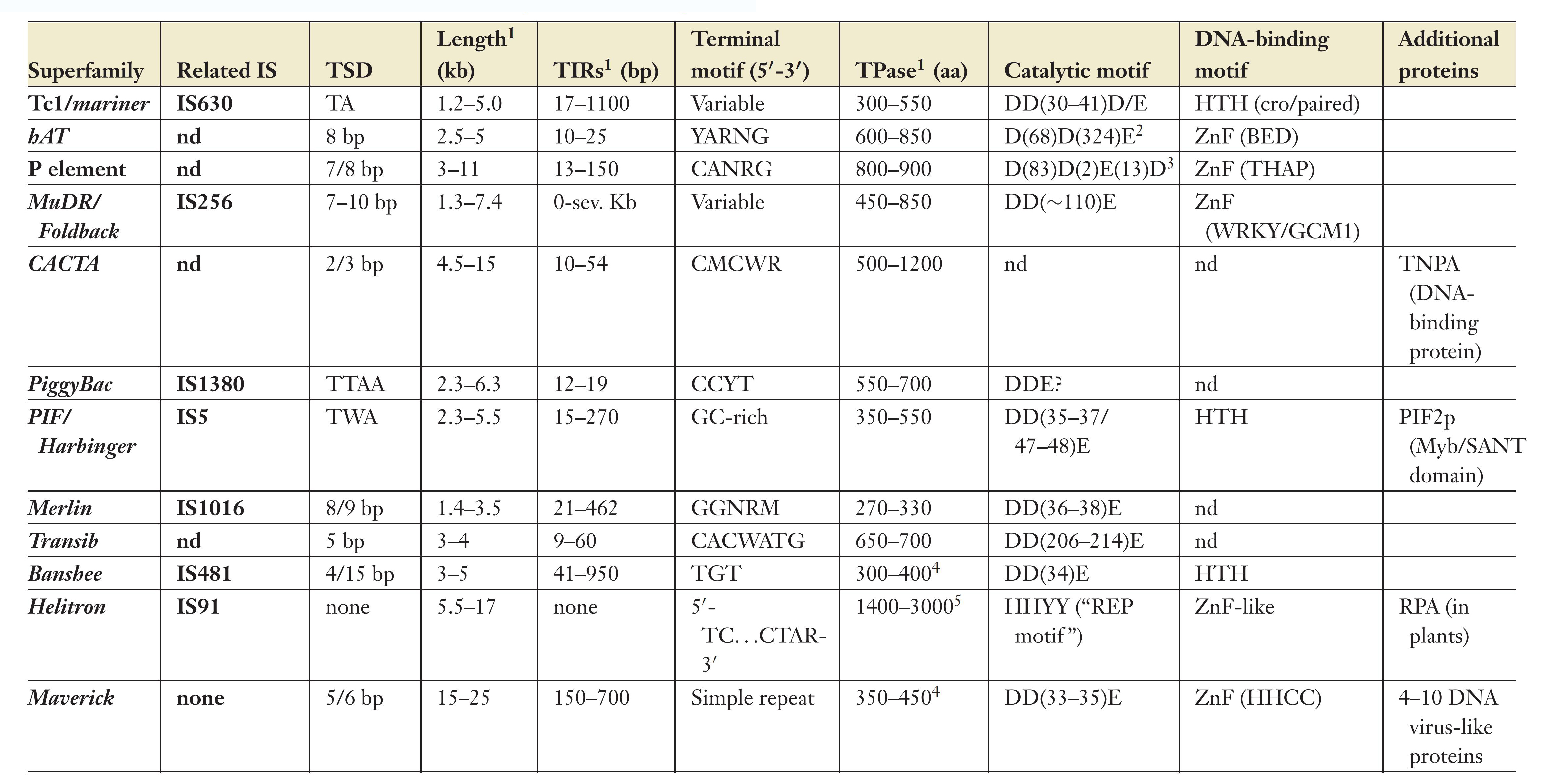
目前,已在真核生物中发现数10种DNA转座子,具体分类和特征如下:
图3. 真核生物DNA转座子分类
转座子可以在基因组任意位置插入和切除,常用于哺乳动物细胞基因编辑研究中。目前发现的可用于哺乳动物基因转移的DNA转座子系统主要有3类:类hAT转座子Tol 2,两个类Tc1转座子Sleeping Beauty ( SB) 和 Frog Prince ( FP),Piggy Bac超家族成员Piggy Bac(PB)。其中,PB转座系统凭借其转座效率高,宿主范围广等优势,近年来已在哺乳动物细胞中得到了广泛的应用,也是本文的介绍重点。
二、PB转座系统
1、结构特点
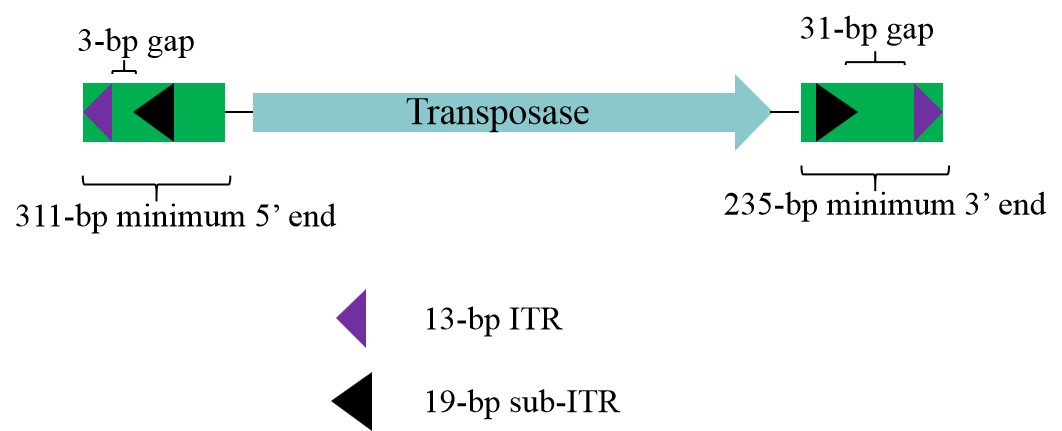
PB转座子属于DNA型转座子,全长2476 bp。PB转座子末端为长13 bp的反向重复序列(ITRs),在其内部不对称分布有19 bp的亚末端反向重复序列(sub-ITRs),sub-ITRs中间有一个1.8 kb的开放阅读框,编码594个氨基酸的piggyBac转座酶,分子量为64 kDa,该转座酶是转座子转座过程所必需的。
图4. PB转座子的结构示意图
2、转座模式
PB转座子的转座遵循“剪切-粘贴”机制,在哺乳动物细胞基因组DNA中靶向TTAA序列。当piggyBac转座酶蛋白在哺乳动物细胞中表达时,它会与转座子的反向重复序列结合,切割DNA并释放转座子两端的3’-OH,3’-OH攻击互补链5’端的TTAA序列并形成发夹结构,从而将转座子从质粒主链中释放出来,断裂的质粒主链会在DNA连接酶的作用下重新连接起来而不留下任何痕迹。与此同时,目标染色体的特定位点(TTAA位点)被剪切为粘性末端双链断口,切下的PB转座子在PB酶的作用下连入被切开的目标染色体中并把粘性末端补平,从而导致被插入目标染色体的转座子两侧都存在TTAA。
在大多数应用中,piggyBac转座酶和piggyBac转座子分别由两个单独的质粒携带,通过瞬时转染的方式导入细胞,因而会逐渐丢失,转座酶的丢失使转座子在宿主基因组中实现永久整合。当细胞中再次表达PB转座酶时,会把转座子从宿主基因组上切除,使宿主基因组恢复原状,序列不会发生任何改变,这称为“无缝切除”。
图5. PB转座子的作用机制
3、优势
①转座效率高。 PB转座系统靶向于基因组的TTAA位点,而在基因组中TTAA序列出现较为频繁,平均每246 bp便会出现一个TTAA位点。
②装载容量大。PB转座系统携带的外源片段可长达几十Kb。
③可介导外源基因的稳定整合和表达。
④插入位置易检测。可利用反式PCR方法迅速而精确地进行突变位点的检测。
⑤可以实现“无缝切除”。转座酶的再次表达可将导入的外源基因切除, 而不影响内源基因的表达。
三、腺病毒与转座子联手,助力体内外研究
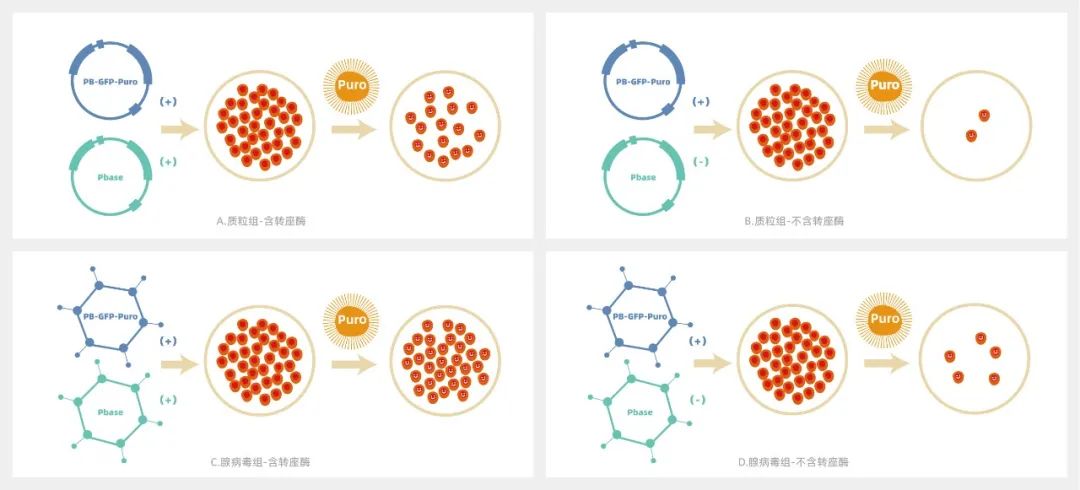
在实际应用过程中,转座酶和转座子分别被构建在两个载体上,而后导入细胞。无论是质粒组还是腺病毒组,添加转座酶组细胞存活数量要远远多于未添加组,说明转座酶在转座过程中的必需性;而腺病毒组细胞存活数量整体多于质粒组,说明腺病毒转座体系的效率更强。(图A、B为质粒转座体系,图C、D为腺病毒转座体系)
质粒转座子体系 pk 腺病毒转座子体系
1、腺病毒转座体系较质粒转座体系效率更高
首先,我们将PB转座子和转座酶分别构建至腺病毒载体并包装腺病毒,分别通过质粒和病毒感染两种方式处理A549细胞。发现,质粒转染48小时,Puro加压7天后,加转座酶组细胞大量存活,而对照组细胞几乎全部凋亡。腺病毒感染48小时,Puro加压两周后,加转座酶组细胞稳转扩增,对照组细胞逐渐凋亡(如下图所示)。这说明,转座酶在转座子转座过程是必需的,且腺病毒转座子比质粒转座子转座效率更高。
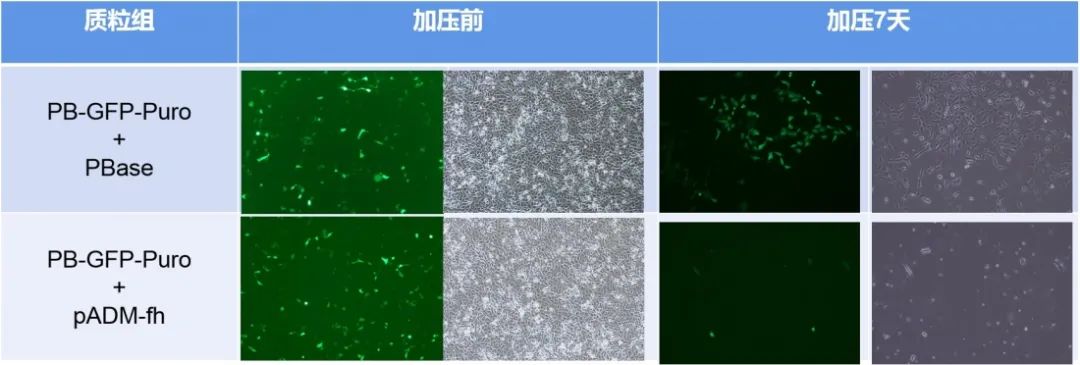
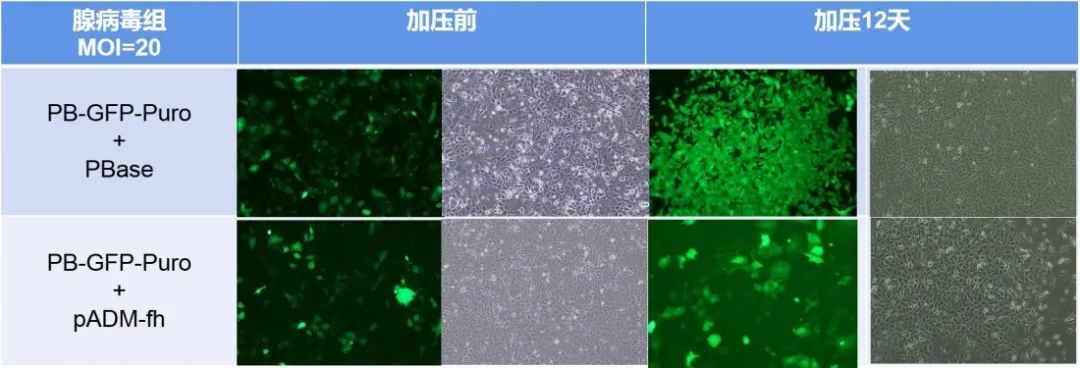
质粒组与病毒组实验结果
2、腺病毒-PB转座体系效率分析
为评估腺病毒-PB转座体系的转座效率,我们对腺病毒组存活细胞数量进行了分析。计数与染色结果显示,加转座酶组的存活细胞数量是未加转座酶组的近33倍(如下图所示)。
腺病毒组存活细胞数分析
结语
腺病毒与PiggyBac转座系统的融合,既可进行细胞的高效感染,又可实现外源基因在宿主细胞的稳定整合与表达。因此,如果您有基因的稳转需求,无论是常规基因还是较大基因,常规细胞还是难感染的细胞,体内研究还是体外研究,都可以优先选择腺病毒-PB转座体系。利用这一体系可以完美地解决稳转株构建以及外源基因在动植物体、组织中稳定表达的难题,尤其是对那些较大基因来说,这一体系尤其适用,欢迎各位老师咨询订购!
维真生物腺病毒-PB转座系统部分载体
|
载体名称
|
启动子
|
抗生素
|
荧光蛋白
|
|
pADM-PB-CMV-EGFP-mCMV-Puro
|
CMV
|
Puro
|
GFP
|
|
pADM-PBase
|
CMV
|
/
|
/
|
参考文献
[1].Yusa, K., piggyBac Transposon. Microbiol Spectr, 2015. 3(2): p. MDNA3-0028-2014.
[2].Woodard, L.E. and M.H. Wilson, piggyBac-ing models and new therapeutic strategies. Trends Biotechnol, 2015. 33(9): p. 525-33.
[3].Hickman, A.B. and F. Dyda, DNA Transposition at Work. Chem Rev, 2016. 116(20): p. 12758-12784.
[4].Feschotte, C. and E.J. Pritham, DNA transposons and the evolution of eukaryotic genomes. Annu Rev Genet, 2007. 41: p. 331-68.
[5].Wu, S.C., et al., piggyBac is a flexible and highly active transposon as compared to sleeping beauty, Tol2, and Mos1 in mammalian cells. Proc Natl Acad Sci U S A, 2006. 103(41): p. 15008-13.
 当前位置:首页 > 新闻中心 > 新品发布
当前位置:首页 > 新闻中心 > 新品发布