 当前位置:首页 > 新闻中心 > 新品发布
当前位置:首页 > 新闻中心 > 新品发布
维真生物基于全面的病毒包装平台和稳定的生产工艺,将Monkeypox Virus (MPV)特异性靶标序列F3L和包膜蛋白B6R的基因序列,分别克隆构建至慢病毒,腺病毒和腺相关病毒(AAV)载体上,成功开发出高质量的猴痘假病毒系列产品,并且具有良好的生物安全性和稳定性。
腺相关病毒(Adeno-associated virus,AAV)凭借高组织特异性、低免疫原性、高安全性和稳定性等优点,已成为基因递送的理想工具。AAV血清型众多,不同血清型有着不同的组织嗜性,为科研和临床提供多样化的选择。然而天然的AAV通常特异性不够,而且机体通常对这些天然AAV存在先天免疫甚至抗体,这样一来可能会干扰病毒与细胞的相互作用,影响科研及基因治疗的结果。因此,获取更强组织靶向性的AAV血清型,已成为科学家们探索和开发的方向。
大脑是中枢神经系统(Central Nervous System,CNS)的重要组成部分,很多神经退行性疾病如阿尔茨海默症和帕金森病等都与大脑组织的病变密切相关,以大脑为靶点的基因疗法逐渐成为了当今神经疾病研究的热点。天然AAV血清型倾向于靶向非CNS的器官或组织,尤其是肝脏。肝脏是一个具有免疫活性的器官,AAV靶向这些组织会引发免疫反应,降低系统注射AAV的安全性和有效性。同时由于血脑屏障的存在,天然AAV血清型在大脑中的转导效率也受到严重限制。
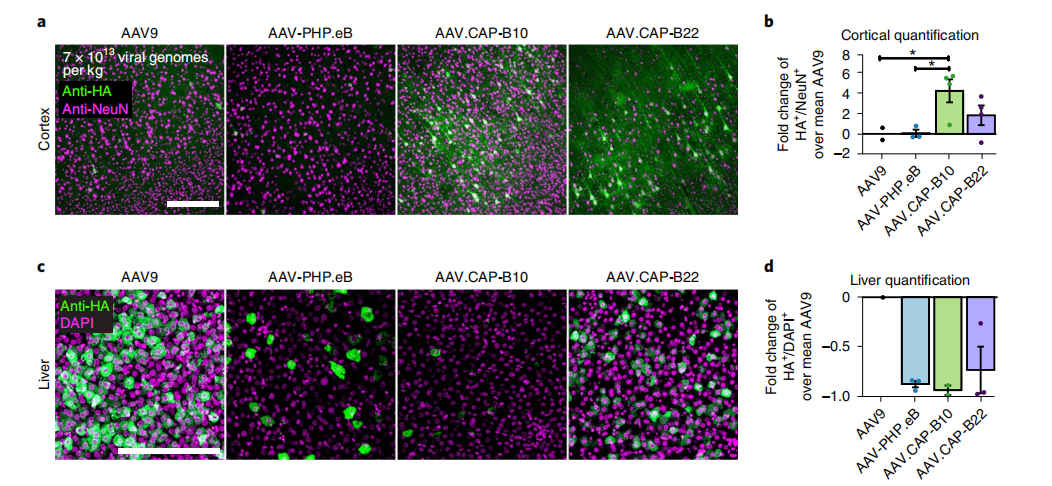
加州理工学院的 Viviana Gradinaru 团队通过对AAV9进行衣壳改造,开发了一系列AAV变体,其中AAV.CAP-B10,静脉注射后,不仅能够突破血脑屏障,高效靶向神经元细胞,同时不会在肝脏富集。
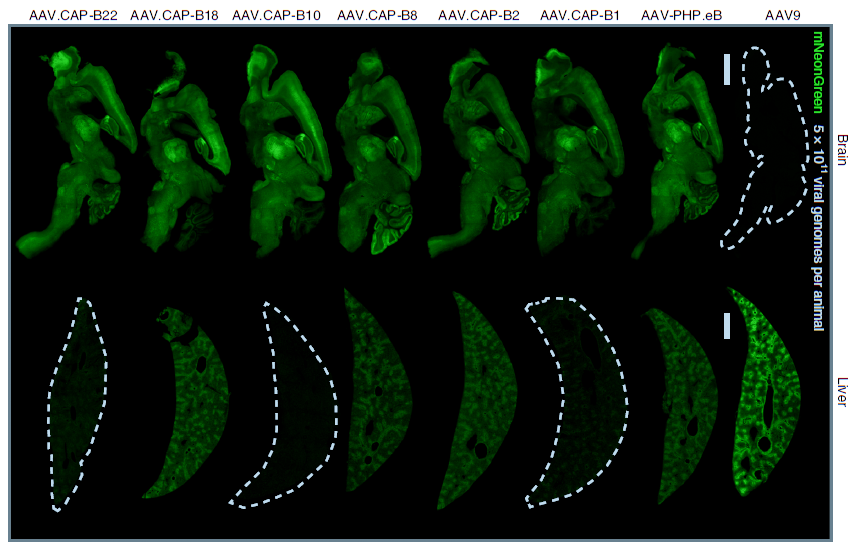
该研究团队对比了不同AAV血清型通过静脉注射在各组织器官中的递送效率,结果发现,AAV.CAP-B10表现出对中枢神经系统的特异性,高度靶向神经元细胞,对肝脏具有低靶向性,这一结果不仅在小鼠上得到了证实(图1),在非人灵长类动物狨猴上也得到了证实(图2)。这为脑研究工作者提供了新的工具策略,同时这也为脑部疾病提供了一种更安全、有效的治疗选择。
星形胶质细胞是中枢神经系统损伤的关键反应细胞,在脊髓损伤的发病机制中发挥着重要作用。星形胶质细胞功能障碍已被证实是脑卒中、阿尔茨海默病、帕金森病和亨廷顿病等神经退行性疾病的核心特征。
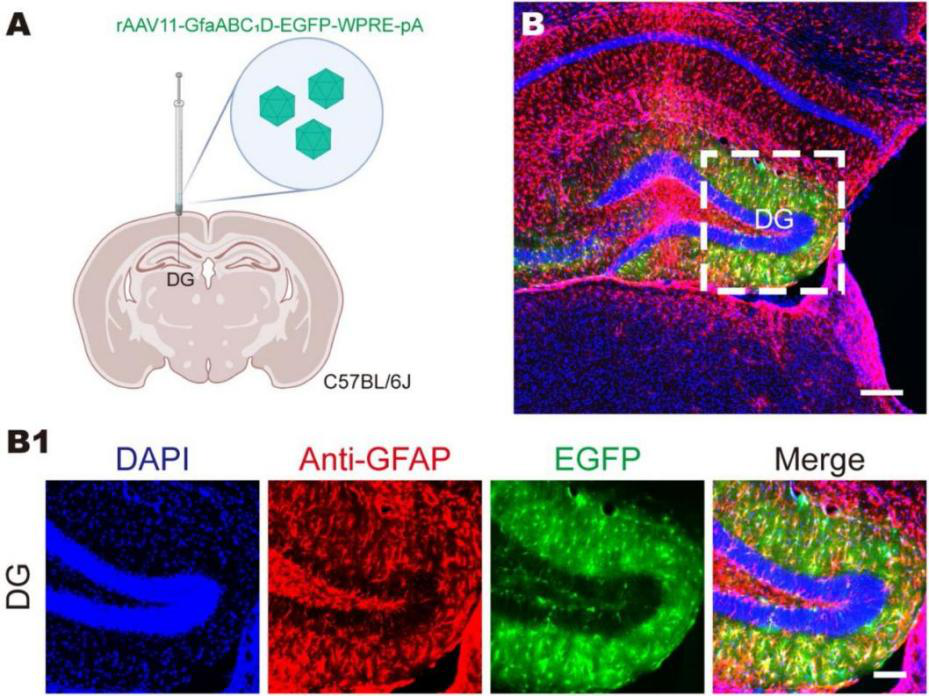
中科院徐富强团队对一系列工具病毒进行改造和筛选,开发了一种新的高效逆行靶向投射神经元的重组腺相关病毒rAAV11。研究发现,rAAV11可以高效逆行靶向投射神经元,且不表现出顺行跨突触特征;rAAV11还具备优秀的逆行标记效率,能示踪rAAV2难以转导的投射神经元。值得注意的是,rAAV11可以高效且特异性靶向星形胶质细胞,为星形胶质细胞的研究提供了更加有力的病毒工具。
小胶质细胞是中枢神经系统的常驻免疫细胞,能协调免疫反应并动态塑造中枢神经系统的神经回路。小胶质细胞功能障碍和基因突变是许多CNS疾病的直接原因:绝大多数神经退行性疾病的风险基因都在小胶质细胞中特异性表达或高表达;小胶质细胞吞噬、激活或免疫调节功能的基因突变也会导致严重的CNS病变。
北京生命科学研究所罗敏敏实验室通过定向进化策略,开发了一系列能够在体内和体外高效侵染小胶质细胞的新型rAAV载体。该研究针对AAV9的衣壳蛋白进行改造,鉴定筛选出两个衣壳蛋白(AAV-cMG.WPP和AAV-cMG.QRP)能够在一定程度上提高rAAV病毒对体外培养的小鼠小胶质细胞的侵染效率。以此为基础,研究团队针对AAV-cMG.QRP的插入肽段及其在衣壳蛋白插入位点的相邻氨基酸进行突变筛选,成功得到了高效侵染体外培养小胶质细胞的AAV-cMG衣壳蛋白,同时并不导致小胶质细胞的激活。

研究人员进一步在AAV-cMG.WPP基础之上构建新的AAV突变文库,并在小胶质细胞特异的Cx3cr1-CreER转基因小鼠脑内进行针对性体内筛选,成功鉴定得到AAV-MG1.1和AAV-MG1.2,能够在体内高效侵染小胶质细胞,且不诱导小胶质细胞免疫激活。
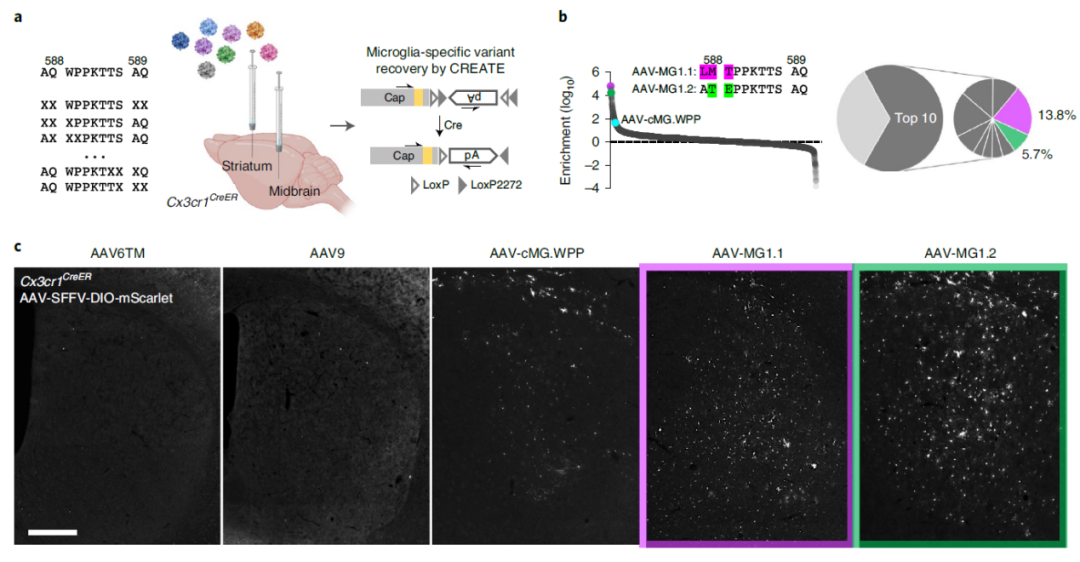
这两类分别适用于体外侵染培养小胶质细胞(AAV-cMG)和体内侵染内源性小胶质细胞(AAV-MG)的新型rAAV载体,将有助于小胶质细胞生物学及相关疾病机制的研究。
脑血管内皮细胞是表达在血管腔隙的一类中枢非神经元细胞群体,作为血脑屏障的重要组成部分,参与许多关键的生理过程。此外,内皮细胞在神经系统功能中起着至关重要的作用,越来越多的证据表明内皮细胞损伤是导致各类神经系统疾病的主要原因。研究表明CNS内皮细胞有着高度特异的分子功能:动脉内皮细胞在血液流动与神经活动的动态耦合中发挥关键作用,毛细血管内皮细胞抑制胞运以保持血脑屏障的完整性,而静脉内皮细胞与神经免疫交叉密切相关。
美国麻省理工学院-哈佛大学布罗德研究所的Benjamin E. Deverman组和哈佛医学院的Chenghua Gu组开发了一种新的血清型AAV-BI30,可在多个鼠系体内以及体外高效转导内皮细胞。在相对较低的全身剂量下,该载体可转导成年C57BL/6小鼠大脑、视网膜和脊髓血管系统中的大多数动脉、毛细血管和静脉内皮细胞。

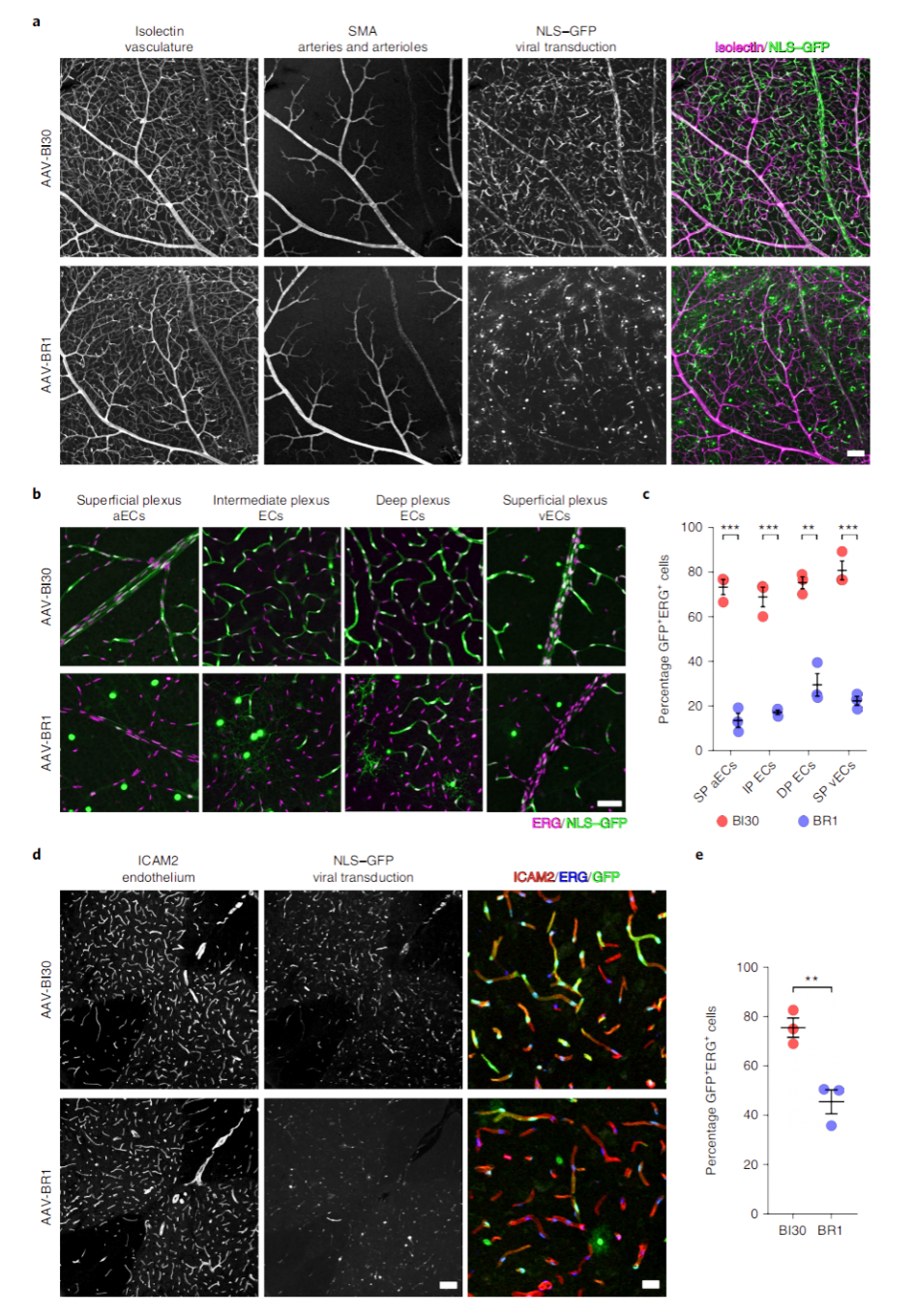
此外,AAV-BI30在CNS中能实现高效的Cre介导的基因操纵。AAV-BI30能高效的在中枢不同类型血管内皮细胞中特异性表达,适用于神经血管生物学相关研究,并有助于开发内皮功能障碍类疾病的治疗方法。
内皮细胞在血管疾病的病理进展中发挥着重要作用,一旦内皮细胞出现功能障碍,就会导致诸如高血压、动脉粥样硬化以及心血管疾病等。对内皮细胞进行高效持久的基因转导对于内皮细胞功能的研究至关重要。
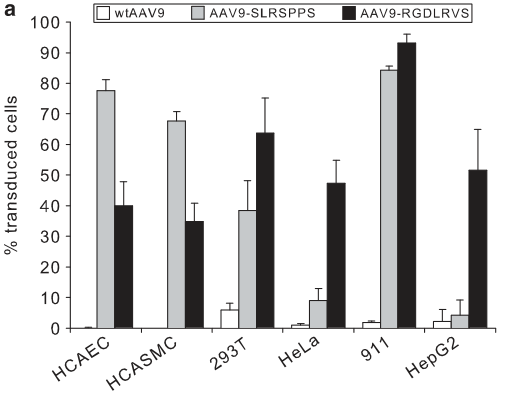
研究者在rAAV9衣壳A589位点插入七肽进行文库构建,筛选了得到两种插入肽载体AAV9-RGDLRVS和AAV9-SLRSPPS,以流式筛选荧光确认感染效率。数据显示,两种插入肽的rAAV9载体对人冠状动脉内皮细胞(HCAEC)、人冠状动脉平滑肌细胞(HCASMC)、肝肾等来源的永生化细胞(HEK293T,HeLa,911,HepG2)的感染效率显著高于天然AAV9载体。与天然AAV9载体相比,AAV9-RGDLRVS内皮细胞转导效率提高了40倍。此外,AAV9-SLRSPPS在人脐静脉内皮细胞的转导效率也较高。
维真生物基于多年的病毒包装经验和稳定的制备工艺,可以为客户包装上述血清型的AAV病毒,为更多组织特异性的探究提供更多的可能和选择,同时也为各位科研工作者提供更多的便利和支持!欢迎各位老师垂询!