 当前位置:首页 > 研究领域 > 神经系统
当前位置:首页 > 研究领域 > 神经系统
大脑是人体中枢神经系统中最高级的部分,是思维的器官,是心智和意识的物质本体,也是结构最复杂、功能最完善的器官,其对生命之重毋庸置言。虽然近几十年神经科学得到了快速的发展,然而,时至今日大脑仍属于人类知之甚少的人体构造之一。
脑行使功能的结构基础是神经环路,那么如何解析大脑不同脑区、不同类型神经元之间神经环路的结构和功能呢?神经示踪技术是带领我们探索大脑功能的工具之一。传统的神经示踪技术存在诸多缺点,如无法实现细胞特异性标记、无法携带基因、信号衰减等。作为新兴神经示踪工具的病毒载体为这些问题的解决提供了新方案,是目前最为有效、应用最广的示踪工具。基于噬神经病毒发展来的狂犬病毒(RV)和伪狂犬病毒(PRV)是成熟的、广泛使用的跨突触逆向病毒示踪剂;而基于噬神经病毒发展来的单纯疱疹病毒(HSV)和水疱性口炎病毒(VSV)可以实现跨突触顺向标记,但是其神经毒性和跨突触不可控,限制了其在解析神经环路研究中的应用,因此,这迫切需要我们寻找一种优良的跨突触顺向病毒示踪剂。
除噬神经病毒外,AAV近年也被用于环路示踪,因为AAV具有复制缺陷性和极低的免疫原性,不会造成大量的神经毒性。大部分的研究使用AAV进行非跨突触标记。2014 Castle等人发现AAV1可顺向示踪神经元,但是其潜在跨突触的证据还不清楚并存在争议。直到2017年,南加利福尼亚大学的 张砺教授带领的团队在《Neuron》发表的“AAV-Mediated Anterograde Transsynaptic Tagging: Mapping Corticocollicular Input-Defined Neural Pathways for Defense Behaviors”,首次证实了AAV可顺向跨单级突触传导,研究表明高滴度的AAV2/1-hSyn-Cre能有效、特异跨单级突触标记神经元及其输出,这为利用顺向跨突触病毒工具研究大脑复杂功能提供了可能性。
今天小V和大家分享AAV顺向跨突触传导的最新研究成果。

2020年4月,张砺教授带领的团队又在《The Journal of Neuroscience》发表题为“Synaptic Specificity and Application of Anterograde Transsynaptic AAV for Probing Neural Circuitry”的论文,深入研究了AAV病毒顺向跨突触传导的突触特异性和在多种神经环路中的广泛应用。
解剖结构的研究结果如下图:在Ai14 x GAD67-GFP 小鼠的脑桥核PN和下橄榄核IO分别注射scAAV1-hSyn-Cre,发现小鼠的来自PN的投射标记出小脑大量的颗粒细胞GCs,而小鼠的来自IO的投射标记出小脑中的浦肯野细胞PCs,从而证实了AAV顺向跨突触传导可特异性标记突触后的细胞群。

进一步研究了AAV顺向跨突触传导的突触特异性的功能特征(见下图)。将scAAV1-hSyn-Cre和AAV1-EF1a-DIO-ChR2-YFP 1:1混合注射入Ai14 小鼠初级视觉皮层V1,只有共转这2种病毒的神经元才能表达ChR2,采用全细胞记录技术,蓝光诱发突触前神经元兴奋,产生动作电位,动作电位传导到突触后神经元也可以产生神经冲动,发现其功能性连接的下丘神经元IC被标记,且在TTX和4-AP存在的时候没有变化。证明AAV1更倾向于标记注射点下游突触连接的神经元。

作者探究了AAV1从突触末端释放的机理(见下图)。将AAVDJ-CMV-TeNT-P2A-GFP ( AAV1-hSyn-GFP 作为对照) 注射入Ai14小鼠的初级视觉皮层V1。14天后在同一脑区注射入scAAV1-hSyn-Cre,并在2周后检测上丘SC中 tdTomato+细胞数目。结果显示:TeNT组跨突触标记tdTomato +细胞数目较对照组减少约94%。TeNT可通过切割VAMP2从而完全阻断Ca2+诱发的突触囊泡融合和神经递质的释放,从而证实了AAV的传导明显依赖于突触囊泡的释放。

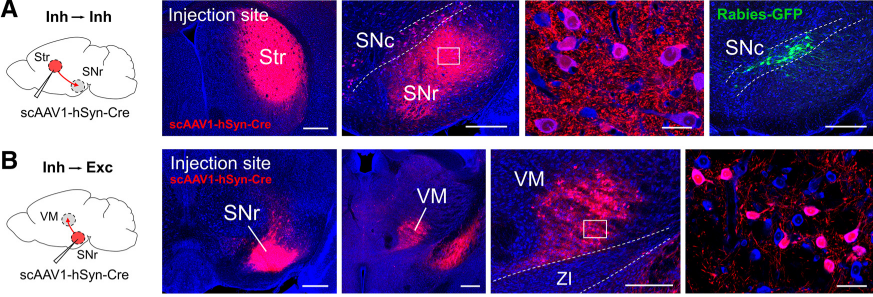
抑制性神经环路中的研究结果见下图。将scAAV1 - hSyn - Cre注射到纹状体Str中,Str中含有GABA能棘状神经元,它可以投射到黑质网状核SNr中的抑制性细胞。14天后,发现SNr中的神经元被标记;此外,作者还测试了AAV1从SNr中的抑制性神经元扩散到丘脑腹内侧核VM中的兴奋性神经元的概率,发现VM中也有相当数量的神经元被标记,证明AAV1可以用于抑制性神经元投射顺向跨突触标记不同类型的多种细胞。
神经调质神经环路中的研究结果见下图。将scAAV1-hSyn-Cre注射入Ai14 小鼠斜带核NDB、背侧中缝核DR和蓝斑LC中,14天后,发现其投射的下游脑区神经元被稀疏或者零标记。证明AAV1顺向跨突触标记能力在神经调质能的神经环路中的应用比较局限:在谷氨酸和γ氨基丁酸神经环路中,AAV1具有高效的顺向跨突触标记能力;而乙酰胆碱、五羟色胺和去甲肾上腺素神经环路中则显得极其逊色。

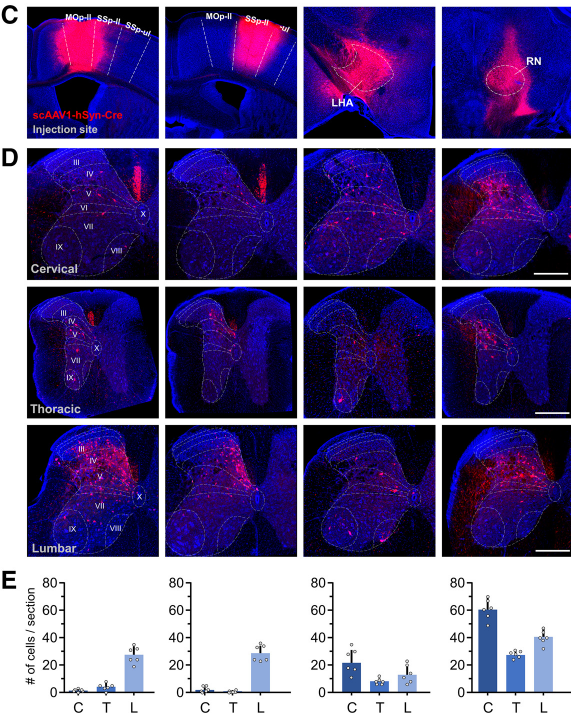
脑-脊髓投射神经环路中的研究结果见下图。将scAAV1-hSyn-Cre注射入Ai14 小鼠的初级运动皮层Mop-II、初级躯体感觉皮层SSP-II、外侧下丘脑LHA、红核RN中,14天后,发现脊髓颈椎、胸椎和腰椎处神经元被不同程度标记,证明AAV1在脑-脊髓投射神经环路中具有顺向跨突触标记能力,为进一步研究脑-脊髓投射神经环路功能奠定了基础。
通过比较不同AAV血清型和嗜神经病毒,发现AAV1具有顺向跨突触标记能力,然而AAV1的顺向跨突触标记能力非常弱,需要联合重组酶系统(如Cre or Flp)进行放大,从而启动转基因的强表达。相比AAV1-hSyn-Cre,scAAV1-hSyn-Cre表现出了更优越的顺向跨突触标记能力:本研究从解剖、功能和分子层面深入研究了AAV1顺向跨突触传导的突触特异性,并阐述了其作用机制整体上依赖于突触囊泡的释放;scAAV1-hSyn-Cre可在兴奋性、抑制性、神经调质和脑-脊髓等多种神经环路中有效、特异地标记单突触靶神经元及其输出,从而解析不同的功能/行为。总之,scAAV1-hSyn-Cre具有有效、特异跨突触标记能力,鉴于其同时具有低概率的逆向示踪能力,它仅适用于精确标记单向神经环路,通过与其它技术(如转基因动物和稀疏标记等)的联合运用可以满足神经研究人员的多种实验需求。
本文献中的部分AAV病毒由维真生物提供,如下表所示:
| 病毒名称 |
|---|
| scAAV1 hSyn-Cre |
| AAV1 hSyn-Flp |
| AAVretro-hSyn-Cre |
| AAV1-EF1a-DIO-Flp-WPRE |
| AAVretro-hSyn-GFP-WPRE |
下表所示为维真生物多种AAV产品,如有需要,欢迎致电400-077-2566!
| 产品编号 | 产品名称 |
|---|---|
| Cre/Flp | |
| AV204006-AV1 | AAV1-hSyn-Cre |
| AV204046-AV1 | scAAV1-hSyn-Cre |
| AV204006-AV2 retro | AAV2 retro-hSyn-Cre |
| AV204049-AV1 | AAV1-hSyn-Flp |
| AV204050-AV1 | AAV1-CAG-DIO-Flp |
| AV204054-AV1 | AAV1-EF1a-DIO-Flp |
| …… | |
| 产品编号 | 产品名称 |
|---|---|
| 荧光蛋白(标记神经元) | |
| AV200001-AV2 retro | AAV2 retro-CMV-GFP |
| AV200007-AV2 retro | AAV2 retro-hSyn-GFP |
| AV200109-AV1 (Cre依赖) | AAV1-CAG-DIO-GFP |
| AV200160-AV2 (Cre依赖) | AAV2-CAG-DIO-mCherry |
| AV200145-AV9 (Cre依赖) | AAV9-EF1a-DIO-mCherry |
| AV200096-AV2 (Cre依赖) | AAV2-hSyn-DIO-GFP |
| AV200096-AV9 (Cre依赖) | AAV9-hSyn-DIO-GFP |
| AV200146-AV9 (Cre依赖) | AAV9-hSyn-DIO-mCherry |
| AV200117-AV9 (Cre依赖) | AAV9-CaMKIIa-DIO-GFP |
| AV200147-AV5 (Cre依赖) | AAV5-CaMKIIa-DIO-mCherry |
| AV200147-AV9 (Cre依赖) | AAV9-CaMKIIa-DIO-mCherry |
| …… | |
| 光遗传学(操控神经元) | |
| AV201006-AV2 (Cre依赖) | AAV2-EF1a-DIO-hChR2(H134R)-mCherry |
| AV201006-AV9 (Cre依赖) | AAV9-EF1a-DIO-hChR2(H134R)-mCherry |
| AV201007-AV2 (Cre依赖) | AAV2-EF1a-DIO-hChR2(H134R)-EYFP |
| AV201007-AV9 (Cre依赖) | AAV9-EF1a-DIO-hChR2(H134R)-EYFP |
| AV201017-AV9 (Cre依赖) | AAV9-EF1a-DIO-eArch3.0-EYFP |
| AV201021-AV9 (Cre依赖) | AAV9-EF1a-DIO-eNpHR3.0-EYFP |
| AV201003-AV2 (Cre依赖) | AAV2-CaMKIIa-DIO-hChR2(H134R)-mCherry |
| …… | |
| 化学遗传学(操控神经元) | |
| AV202014-AV9 (Cre依赖) | AAV9-EF1a-DIO-hM4D(Gi)-mCherry |
| AV202010-AV9 (Cre依赖) | AAV9-hSyn-DIO-hM4D(Gi)-mCherry |
| AV202015-AV9 (Cre依赖) | AAV9-CaMKIIa-DIO-hM4D(Gi)-mCherry |
| …… | |
| 钙指示剂(神经元成像) | |
| AV203006-AV8 (Cre依赖) | AAV8-EF1a-DIO-GCaMP6s-P2A-nls-dTomato |
| AV203006-AV9 (Cre依赖) | AAV9-EF1a-DIO-GCaMP6s-P2A-nls-dTomato |
| AV203009-AV8 (Cre依赖) | AAV8-EF1a-DIO-GCaMP6m-P2A-nls-dTomato |
| AV203009-AV9 (Cre依赖) | AAV9-EF1a-DIO-GCaMP6m-P2A-nls-dTomato |
| AV203009-AV2 retro (Cre依赖) | AAV2-retro-EF1a-DIO-GCaMP6m-P2A-nls-dTomato |
| AV203009-AV DJ (Cre依赖) | AAV-DJ-EF1a-DIO-GCaMP6m-P2A-nls-dTomato |
| AV203016-AV9 (Cre依赖) | AAV9-EF1a-DIO-GCaMP6f-P2A-nls-dTomato |
| AV203004-AV5 (Cre依赖) | AAV5-hSyn-DIO-GCaMP6s-P2A-nls-dTomato |
| AV203046 | AAV-EF1a-DIO-jGCaMP7b-P2A-nls-dTomato |
| AV203047 | AAV-EF1a-DIO-jGCaMP7c-P2A-nls-dTomato |
| AV203048 | AAV-EF1a-DIO-jGCaMP7s-P2A-nls-dTomato |
| AV203049-AV9 (Cre依赖) | AAV9-EF1a-DIO-jGCaMP7f-P2A-nls-dTomato |
| …… | |
1. Castle MJ, Gershenson ZT, Giles AR, Holzbaur ELF, Wolfe JH (2014a) Adeno-associated virus serotypes 1, 8, and 9 share conserved mechanisms for anterograde and retrograde axonal transport. Hum Gene Ther 25:705-720.
2. Zingg B, Chou X, Zhang Z, Mesik L, Liang F, Tao HW, Zhang LI (2017) AAV-mediated anterograde transsynaptic tagging: mapping corticocol-licular input-defined neural pathways for defense behaviors. Neuron 93:33-47.
3. Brian Zingg, Bo Peng, Junxiang Huang, Huizhong W. Tao, and Li I. Zhang(2020) Synaptic Specificity and Application of Anterograde Transsynaptic AAV for Probing Neural Circuitry. The Journal of Neuroscience 40 (16): 3250-3267.