 当前位置:首页 > 研究领域 > 其他
当前位置:首页 > 研究领域 > 其他
肌肉是人体的重要组成部分,不仅是多种肌营养不良疾病基因治疗的靶组织,还可作为生产和分泌治疗远端器官疾病功能蛋白的生物工厂,肌肉组织的这些特征使其成为开发基因治疗策略的通用平台,用于递送相关疾病功能基因。AAV载体是将基因转移到骨骼肌和心肌等肌肉组织的理想载体,经AAV转导后肌肉细胞可以表达功能性重组蛋白,并将这些蛋白分泌到血液中进行全身递送,通过这种策略用于糖尿病、动脉粥样硬化、血友病及癌症等的疾病治疗,目前由AAV介导的肌肉基因治疗已逐步迈入临床。本期我们整理了AAV在肌肉组织的靶向策略以及部分案例,希望对大家的研究有所帮助。
|
名称 |
大小 |
来源 |
描述 |
|
MCK |
1.3 kb |
小鼠 |
肌酸激酶基因启动子 |
|
3×enhancer |
728 bp |
小鼠 |
修改的肌酸激酶基因启动子 |
二、AAV血清型的选择
根据文献报道,AAV1、2、6、7、8和9均可有效转导肌肉组织,但若要实现基因在肌肉组织的更高特异性地表达,通常是建议结合合适的血清型、肌肉特异性启动子以及适当的给药方式来实现。
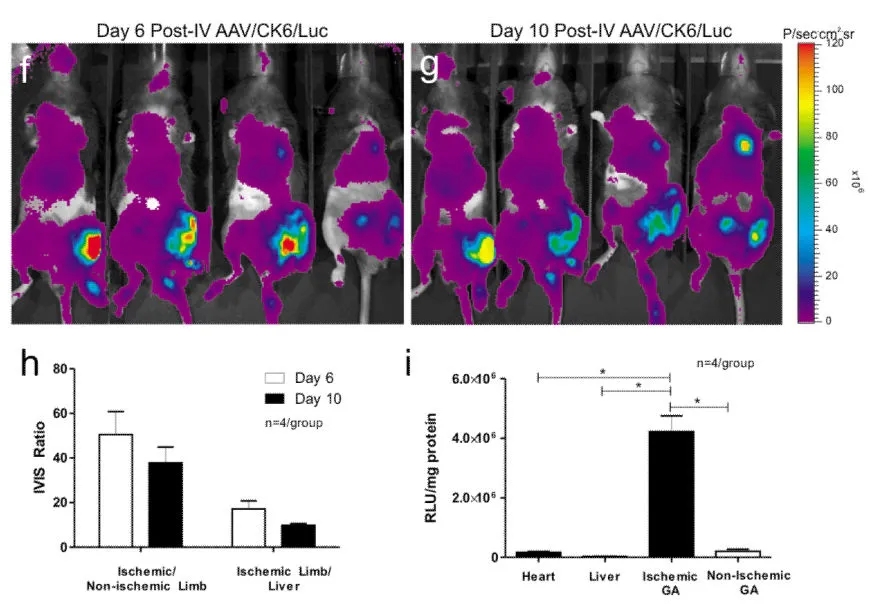
AAV9结合CK6启动子经颈静脉注射后高效靶向缺血性骨骼肌
(Katwal AB, et al. Gene Ther. 2013)
|
实验动物 |
血清型 |
启动子 |
注射方式 |
病毒用量 |
|
成年雄性
C57BL/6小鼠
|
AAV9 |
CK6 |
颈静脉
注射
|
4.15×1011 vg/mouse |
2、AAV1和AAV6均可有效靶向横纹肌,由于AAV6与肝素有较好的亲和力,与AAV1相比,无论是通过肌肉注射还是静脉注射,AAV6都能以更高的效率持续转导横纹肌。

|
实验动物 |
血清型 |
启动子 |
注射部位 |
病毒用量 |
注射体积 |
|
3月龄雄性 C57BL/6小鼠 |
AAV1 |
CMV |
双侧胫骨 前肌 |
108vg |
25 μL病毒稀释液 |
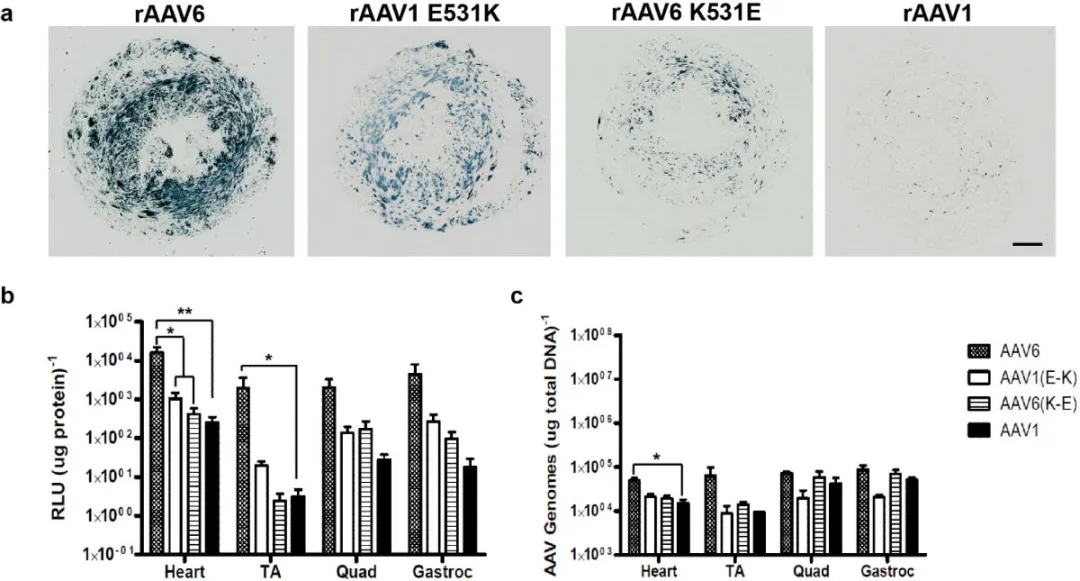
相比AAV1,AAV6经静脉注射后有效靶向横纹肌
(Arnett AL, et al.Gene Ther.2013)
|
实验动物 |
血清型 |
启动子 |
注射部位 |
病毒用量 |
注射体积 |
|
3月龄雄性 C57BL/6小鼠 |
AAV1 |
CMV |
尾静脉 |
2x1012vg |
200 μL |

(Mohammadsharif Tabebordbar,et al.Cell.2021)
|
实验动物 |
血清型 |
启动子 |
注射 |
病毒用量 |
检测 |
|
8周龄 C57BL/6J小鼠 |
AAV9、 |
CMV |
系统 |
1E+12 vg (~4E+13 vg/kg) |
注射后 2周 |
|
方法 |
优点 |
缺点 |
|
|
原位 |
肌肉注射、逆行经静脉肢体灌注、冠状动脉内灌注、心包内注射、心内膜注射、再循环给药 |
转导效率高; 靶向性强; 低免疫反应; |
不能转导大肌肉群 |
|
系统性注射 |
腹腔注射静脉给药 |
广泛转导大肌肉群乃至全身肌肉 |
高剂量载体需求易产生脱靶和免疫毒性;AAV血清型有限 |
下面简述肌肉注射方式的操作步骤:
1、对小鼠进行称重,腹腔注射甲苯噻嗪/氯胺酮混合液将小鼠麻醉;
2、对小鼠右胫前肌进行刮毛及消毒处理;
3、使用适当大小的注射器及针头,以避免触碰到坐骨神经的方式入针,将病毒载体注入右胫前肌;
4、将针头缓慢抽出,轻轻施加压力以防止回流;
5、将小鼠放在加热垫上直至恢复,然后放回笼中饲养观察,注射病毒4周后可检测转基因的表达。

小鼠肌肉注射示意图
(https://www.theodora.com/rodent_laboratory/injections.html)
四、不同注射方式的AAV给药剂量
|
注射 |
推荐 |
推荐注射体积 |
推荐 |
实验 |
|
静脉 |
1×1012~ 1×1014 vg/kg |
200μl病毒稀释液 |
AAV6- |
成年 |
|
肌肉 |
5×108~ 5×1010 vg/site |
胫前肌/腓肠肌:
股四头肌: |
AAV1/2/ |
成年 |
|
心包内注射(针对心肌) |
2.5x109~ 2.5x1011 vg |
50μL |
AAV8 |
新生 |
|
左心室壁注射(针对心肌) |
5x1010~ 5x1011 vg/rat |
不超过250μL, (总量超过250μL可能会导致心脏损伤或者死亡) |
AAV9 |
成年 |
注:选择的血清型和载体的浓度决定了每种注射方式的给药剂量,具体实验时应综合考虑各种因素。