 当前位置:首页 > 专题 > 光遗传 / 化学遗传 / 生物探针
当前位置:首页 > 专题 > 光遗传 / 化学遗传 / 生物探针

|
1.研究背景
人类大脑约有860亿个神经元,这些神经元由数万亿个突触连接在一起。神经元的主要功能是接收、整合和传递信息。它们通过电化学信号进行交流,并形成神经网络,从而控制动物的认知和行为。
神经科学研究的重点,就是从细胞和分子水平了解神经元如何相互连接和交流,这对于解析动物认知和行为背后的神经环路具有重大意义。兴奋是神经系统信息传递的方式,神经纤维受到刺激后,膜内外电位会产生一系列变化而产生兴奋,兴奋产生后先在同一个神经元上以动作电位的形式传导,兴奋跨过突触间隙时通过电化学信号的转变,再传递到下一个神经元。
突触处有两种类型的化学信使,神经递质和神经调质。神经递质通过突触间隙扩散,特异地作用于突触后细胞上的受体,从而完成信息传递功能。而神经调质则与突触后细胞上的受体结合后,增强或削弱递质的效应,从而调节突触信息传递。例如,谷氨酸和γ-氨基丁酸等神经递质结合突触后细胞上的受体后,可以迅速地使突触后神经元去极化或超极化,进而直接调控这些神经元的活动。对于神经调质,它们大多与GPCRs结合后诱发突触前或突触后电位,不直接引起突触后生物学效应,但能调节递质在突触前的释放及突触后细胞的兴奋性,调节突触后细胞对递质的反应。
操控和检测神经元之间的交流是神经科学研究的主要手段,许多遗传工具已经被开发出来,这些遗传工具通过腺相关病毒(AAV)等病毒载体用于神经环路的操控和成像。目前,光遗传学和化学遗传学工具被用来直接操控突触前神经元动作电位的产生,钙成像用于检测突触后神经元内的信号传递。然而,高灵敏度、高特异性和高时空分辨率的神经递质和神经调质检测技术还不成熟。
传统的神经递质检测技术,主要是通过微透析对脑脊液进行采样并生化监测、通过碳纤电极进行记录,这些检测手段各自存在诸多弊端,例如特异性差、灵敏度低和时空分辨率差,难以精确反映神经递质的真实动态信息等。为了解决这一系列的问题,众多神经科学家一直在致力于优化已有的方法或者开发新的技术,以求弥补短板,取得突破。
2.开发&原理
自2018年起,北京大学李毓龙教授课题组通过偶联GPCR和循环重排荧光蛋白cpFP开发出了很多检测神经递质的可遗传编码的荧光探针。神经递质与GPCR的结合会引起后者构象的改变,而这种变化又会引起cpFP发生构象改变,进而影响其发色团周围的微环境,最终导致其荧光强度的改变,这种荧光变化可以通过荧光显微镜检测到(Fig 1a和1b)。这些可遗传编码的荧光探针被命名为GRAB(GPCR Activation-Based)探针,用于以较高的时空分辨率在体检测神经递质的动态变化。

|
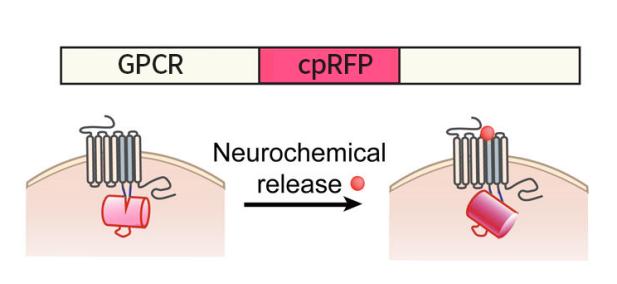
|
| Fig1a:绿色神经递质探针(cpEGFP-based)的工作原理 | Fig1b:红色神经递质探针(cpmApple-based)的工作原理 |
3.探针特征(已发表)

|
探针名称 |
所检测神经 |
版本 |
颜色 |
骨架 |
亲和力 |
信号响应幅度 |
动力学 |
下游 |
参考 |
|
|
Ach2.0 |
乙酰胆碱 |
第一代 |
绿色 |
人M3受体 |
EC50~1uM |
ΔF/F0~90% |
τon~200ms, |
弱偶联 |
[8] |
|
|
Ach3.0 |
乙酰胆碱 |
第二代 |
绿色 |
人M3受体 |
EC50~2uM |
ΔF/F0~280% |
τon~112ms, |
几乎不偶联 |
[3] |
|
|
Ach3.0-mut |
乙酰胆碱 |
第二代对照 |
绿色 |
人M3受体 |
EC50~0uM (W200A突变) |
ΔF/F0~1.8% |
- |
- |
[3] |
|
|
DA1m |
多巴胺 |
第一代 |
绿色 |
人D2受体 |
EC50~130nM |
ΔF/F0~90% |
τon~60ms, |
几乎不偶联 |
[7] |
|
|
DA1h |
多巴胺 |
第一代 |
绿色 |
人D2受体 |
EC50~10nM |
ΔF/F0~90% |
τon~140ms, |
几乎不偶联 |
[7] |
|
|
DAmut(1st) |
多巴胺 |
第一代对照 |
绿色 |
人D2受体 |
EC50~0uM C118A和S193N突变 |
无效应 |
- |
- |
[7] |
|
|
DA2m(DA4.4) |
多巴胺 |
第二代 |
绿色 |
人D2受体 |
EC50~90nM |
ΔF/F0~340% |
τon~40ms, |
非常小的偶联 |
[2] |
|
|
DA2h(DA4.3) |
多巴胺 |
第二代 |
绿色 |
人D2受体 |
EC50~7nM |
ΔF/F0~280% |
τon~50ms, |
非常小的偶联 |
[2] |
|
|
DAmut(2nd) |
多巴胺 |
第二代对照 |
绿色 |
人D2受体 |
EC50~0uM C1183.36A和S1935.42N突变 |
无效应 |
- |
- |
[2] |
|
|
rDA1m (rDA2.5m) |
多巴胺 |
- |
红色 |
人D2受体 |
EC50~95nM |
ΔF/F0~150% |
τon~80ms, |
非常小的偶联 |
[2] |
|
|
rDA1h (rDA2.5h) |
多巴胺 |
- |
红色 |
人D2受体 |
EC50~4nM |
ΔF/F0~100% |
τon~60ms, |
非常小的偶联 |
[2] |
|
|
rDAmut (rDA2.5mut) |
多巴胺 |
对照 |
红色 |
人D2受体 |
EC50~0uM C1183.36A和S1935.42N突变 |
无效应 |
- |
- |
[2] |
|
|
NE1m(NE2.1) |
去甲肾上腺素 |
- |
绿色 |
人a2A受体 |
EC50~930nM |
ΔF/F0~230% |
τon ~70ms, |
不偶联 |
[6] |
|
|
NE1h(NE2.2) |
去甲肾上腺素 |
- |
绿色 |
人a2A受体 |
EC50~83nM |
ΔF/F0~130% |
τon ~30ms, |
不偶联 |
[6] |
|
|
NEmut |
去甲肾上腺素 |
对照 |
绿色 |
人a2A受体 |
EC50~0uM S5.46A突变 |
无效应 |
- |
- |
[6] |
|
|
Ado1.0 |
腺苷 |
- |
绿色 |
人A2A受体 |
EC50~60nM |
ΔF/F0~130% |
τon~36ms, |
几乎不偶联 |
[4] |
|
|
Ado1.0mut |
腺苷 |
对照 |
绿色 |
人A2A受体 |
EC50~0uM F168A突变 |
无效应 |
- |
- |
|
|
|
5-HT1.0 |
五羟色胺 |
- |
绿色 |
人5-HT2C |
EC50~22nM |
ΔF/F0~250% |
τon~0.2s, |
不偶联 |
[1] |
|
|
5-HTmut |
五羟色胺 |
对照 |
绿色 |
人5-HT2C |
EC50~0uM D1343.32Q突变 |
无效应 |
- |
- |
[1] |
4.探针资源
在李教授组的授权下,山东维真生物可以出售这些探针的病毒产品(AAV产品为主),以帮助神经科学工作者在体内检测乙酰胆碱(ACh)、多巴胺(DA)、去甲肾上腺素(NE)、五羟色胺(5-HT)、组胺(HA)、腺苷(Ado)、腺苷三磷酸(ATP)、血管活性肠肽(VIP)、胆囊收缩素(CCK)、神经肽Y(NPY)、促肾上腺皮质激素释放因子(CRF)、精氨酸血管加压素(AVP)、催产素(OXT)、生长激素抑制素(SST)、神经降压肽(NTS)、内源性大麻素(eCB)、大麻素(AEA)和褪黑素(MT)等各种递质的动态变化,欢迎大家点击“AAV工具” 中的“神经递质探针”进行选购!!!
 |
5.探针载体获取
以上所述所有GRAB探针均由北京大学李毓龙组研发或联合开发。部分探针已经发表,部分探针尚未发表。李毓龙组不仅开发了这些探针,还开发了这些探针的Cre依赖和突变版本,包括红色和绿色的荧光信号,以满足神经科学工作者多样化的实验需求。此外,为了提升探针的性能,这些探针还在持续优化中,不断更新迭代。
以上探针均由维真生物协助提供。其中已发表的探针(产品编号中含PUB的病毒为文章中所用病毒),维真生物均有现货,当天上午下单,下午/次日即可发货;若由于产品脱销无库存,1-2周即可完成入库并发货;您可以通过公司技术热线400-077-2566订购。
如若您对未发表的探针或者探针序列感兴趣,您也可通过上述方式与我们联系,,我们将在第一时间帮您与李教授组沟通,征得李教授组的同意之后,我们也可以出售给您。
6.探针病毒使用
由于血脑屏障的存在,普通的注射方式很难实现病毒在脑区较高且特异性的表达,因此研究者通常需要借助脑立体定位仪将探针病毒注射至特定脑区(详见Fig 2),以感染全脑和局部脑区。
|
|
Fig2:脑立体定位注射的示意图
(Van der Perren, A., et al, V. J. Vis. Exp. (108), e53670, doi:10.3791/53670 (2016)
脑立体定位注射的详细步骤如下:
1. 实验动物称重,进行麻醉;
2. 待实验动物完全麻醉后,用剃毛器将动物头顶眼睛至耳朵之间的毛发剃除干净;
3. 将麻醉后的实验动物固定于脑立体定位仪上,具体操作为:实验动物眼部涂抹青霉素眼药膏以保护其双眼;将门齿挂在门齿挂钩上,确保头部保持固定;检查左右耳杆是否在同一水平上,将左右耳杆通过外耳道插入实验动物耳内。实验动物固定好的标准为:鼻对正中,头部不动,提尾不掉,目测大脑放置水平;
4. 手术:用碘伏对实验动物头皮进行消毒清理,用手术刀沿中间位置剪开头皮,用镊子对表面的结缔组织进行清理,暴露实验动物的颅骨表面;然后进行调平,首先找到前囟这个坐标,并将其归零,然后向左右调平,使左右两侧处于同一水平,调整前后囟,使前后囟也在同一水平。
5.病毒注射:通过查询实验动物的脑立体定位图谱确定待注射脑区的位置(Fig 3a和3b是大鼠和小鼠的脑谱),并确定其坐标值,即ML值(X轴)、AP值(Y轴)、DV值(Z轴);根据目标脑区设定好坐标,移开注射针,用颅骨钻开窗(由于颅骨薄,故务必注意颅骨钻的力度!!),操作时避免伤及脑组织;微量注射器吸取病毒液,随后固定在定位仪上,根据设好的坐标进行病毒注射,注射速度控制在0.1-0.15μl/min,注射剂量视具体实验而定。注射完毕,留针10min,以便病毒液充分吸收,然后慢慢回针。

|
|
| Fig3a:The Rat Brain | Fig3b:The Mice Brain |
6. 缝合头皮并消毒, 完成脑定位注射; 将动物从脑立体定位仪取下, 回笼待苏醒; 动物苏醒后, 正常喂养, 病毒注射后2-4周可检测转基因的表达。
7.常见问题解答
7.1 使用探针AAV病毒注射时,我该使用多大的病毒量?
考虑到病毒批次间的差异,我们建议您直接注射未稀释的病毒原液200-400nl/site。
7.2 神经递质探针在大鼠中是否能像在小鼠中一样表达得很好?
神经递质探针在大鼠中也可以很好地工作。根据李教授组已发表的论文,这些探针可以用在多种有机体中,包括果蝇、斑马鱼、老鼠和斑马雀等。
7.3 你们是否也有广谱启动子或其他组织特异性启动子的探针AAV病毒?
有些探针在开发时已构建了广谱启动子或其他组织特异性启动子的载体,如CAG,EFs,EF1α,CamKIIα,GfaABC1D和TRE等,具体可以参考探针资源部分的表2。当然,如果您对其他组织特异性启动子感兴趣,请参考我们的组织特异性启动子列表(见下表)来选择您感兴趣的启动子。如果您找不到想用的启动子,可以联系我们。
|
组织 |
启动子名称 |
启动子 |
启动子 |
启动子描述 |
启动子应用 |
|
神经 |
hSyn |
471bp |
人源 |
突触蛋白1启动子 |
神经元特异性启动子 |
|
CamKIIa |
1.2kb |
小鼠 |
钙/钙调蛋白依赖性蛋白激酶II α启动子 |
大脑新皮质和海马兴奋性神经元特异性启动子 |
|
|
c-fos |
1.7kb |
小鼠 |
c-fos基因启动子 |
兴奋性神经元启动子 |
|
|
Mecp2 |
230bp |
小鼠 |
甲基 CpG 结合蛋白 2启动子 |
短的神经元特异性启动子 |
|
|
NSE |
1.3kb |
小鼠 |
烯醇化酶启动子 |
神经元特异性启动子 |
|
|
Somatostat(SST) |
1.2kb |
人源 |
生长抑制素I基因的启动子 |
gamma氨基丁酸能抑制性神经元SST亚型特异性启动子 |
|
|
TH |
2.5kb |
大鼠 |
酪氨酸羟化酶基因启动子 |
多巴胺能神经元特异性启动子 |
|
|
GFAP |
2.0kb |
人源 |
胶质纤维酸性蛋白启动子 |
星形胶质细胞特异性启动子 |
|
|
GFAP104 |
845bp |
人源 |
EF1a和GFAP的嵌合型启动子 |
星形胶质细胞特异性启动子 |
|
|
GfaABC1D(truncated GFAP) |
681bp |
人源 |
胶质纤维酸性蛋白启动子 |
星形胶质细胞特异性启动子 |
|
|
ALDH1L1 |
1.3kb |
人源 |
醛脱氢酶1家族成员L1启动子 |
丘脑中星形胶质细胞特异性启动子 |
|
|
MBP |
1.3kb |
人源 |
髓磷脂碱性蛋白启动子 |
少突胶质细胞特异性启动子 |
|
|
肝脏 |
ALB |
2.4kb |
小鼠 |
白蛋白启动子 |
肝脏特异性启动子 |
|
TBG |
460bp |
人源 |
甲状腺素结合球蛋白启动子 |
肝脏特异性启动子 |
|
|
ApoEHCR-hAAT |
1.3kb |
人源 |
载脂蛋白E的肝细胞控制区和人α1抗胰蛋白酶启动子的嵌合启动子 |
肝脏特异性启动子 |
|
|
心脏 |
aMHC |
0.4kb |
小鼠 |
肌球蛋白重链α启动子 |
心脏特异性启动子 |
|
cTNT+intron |
0.7kb |
鸡 |
心肌肌钙蛋白T启动子 |
心肌特异性启动子 |
|
|
眼睛 |
Rep65 |
0.7kb |
小鼠 |
视网膜色素上皮65启动子 |
视网膜色素上皮细胞特异性启动子 |
|
VMD2 promoter |
0.65bp |
人源 |
卵黄形成黄斑性营养不良2基因启动子 |
视网膜色素上皮细胞特异性启动子 |
|
|
胰腺 |
Insulin |
0.85kb |
小鼠 |
胰岛素基因启动子 |
胰腺β细胞特异性启动子 |
|
PDX1 |
2.7kb |
小鼠 |
胰十二指肠同源盒1启动子 |
胰腺β细胞特异性启动子 |
|
|
血管 |
SM22a |
0.45kb |
小鼠 |
SM22α启动子 |
血管平滑肌特异性启动子 |
|
ICAM2 |
0.15kb |
人源 |
细胞间粘附分子2启动子 |
血管内皮特异性启动子 |
|
|
CD68 |
0.7kb |
人源 |
CD68分子启动子 |
单核巨噬细胞特异性启动子 |
|
|
F4/80 |
1.2kb |
小鼠 |
F4/80基因promoter |
巨噬细胞特异性启动子 |
|
|
肌肉 |
MCK |
1.3kb |
小鼠 |
肌酸激酶基因启动子 |
肌肉细胞特异性启动子 |
|
3×enhancer McK |
728bp |
小鼠 |
修改的肌酸激酶基因启动子 |
肌肉细胞特异性启动子 |
|
|
肾脏 |
NPHS1 |
1.2kb |
小鼠 |
Nephrin 1基因启动子 |
肾脏特异性启动子 |
7.4 你们探针AAV病毒的最小规格是多少?
我们的探针AAV病毒是按照50μl/支的规格进行分装的,因此出售的最小规格是50μl。
7.5 AAV血清型很多,你们有其他血清型的探针AAV病毒吗,比如逆行AAV血清型?
对于大多数神经递质探针,我们通常将其包装成AAV9血清型,目前还没有尝试逆行AAV血清型。如果您需要逆行血清型,我们也可以帮您包装。目前我们可以为您包装AAV1,AAV2, AAV5,AAV6,AAV7,AAV8,AAVrh10,AAV retro,AAV ANC80,AAV DJ & AAV DJ-8,AAV PhpB & AAV PhpeB,AAV 7m8和AAV shh10等血清型。
8.参考文献
8.1 Wan, J., et al. (2021). "A genetically encoded sensor for measuring serotonin dynamics." Nat Neurosci.
8.2 Sun, F., et al. (2020). "Next-generation GRAB sensors for monitoring dopaminergic activity in vivo." Nat Methods 17(11): 1156-1166.
8.3 Jing, M., et al. (2020). "An optimized acetylcholine sensor for monitoring in vivo cholinergic activity." Nat Methods 17(11): 1139-1146.
8.4 Peng, W., et al. (2020). "Regulation of sleep homeostasis mediator adenosine by basal forebrain glutamatergic neurons." Science 369(6508).
8.5 Jing, M., et al. (2019). "G-protein-coupled receptor-based sensors for imaging neurochemicals with high sensitivity and specificity." J Neurochem 151(3): 279-288.
8.6 Feng, J., et al. (2019). "A Genetically Encoded Fluorescent Sensor for Rapid and Specific In Vivo Detection of Norepinephrine." Neuron 102(4): 745-761 e748.
8.7 Sun, F., et al. (2018). "A Genetically Encoded Fluorescent Sensor Enables Rapid and Specific Detection of Dopamine in Flies, Fish, and Mice." Cell 174(2): 481-496 e419.
8.8 Jing, M., et al. (2018). "A genetically encoded fluorescent acetylcholine indicator for in vitro and in vivo studies." Nat Biotechnol 36(8): 726-737.