 当前位置:首页 > 专题 > 分子生物学
当前位置:首页 > 专题 > 分子生物学
|
基因载体是基因工程的核心,也是基因治疗中强有力的生物工具,我们先来认识和阅读载体图谱吧。 |
一、载体分类及载体组成元件
载体分类
1、按属性分类:病毒载体和非病毒载体
病毒载体是一种常见的分子生物学工具,可将遗传物质带入细胞,原理是利用病毒具有传送其基因组进入目的细胞,进行感染的分子机制。可发生于完整活体或是细胞培养中。可应用于基础研究、基因疗法或疫苗。用于基因治疗和疫苗的病毒载体应具备以下基本条件:
(1)携带外源基因并能包装成病毒颗粒;
(2)介导外源基因的转移和表达;
(3)对人体不致病;
(4)在环境中不会引起增殖和传播。
非病毒载体一般是指质粒DNA。
2、按进入受体细胞的类型分类:原核载体、真核载体、穿梭载体(含原核和真核2个复制子,能在原核和真核细胞中复制,并可以在真核细胞中有效表达)。
3、按功能分类:克隆载体、表达载体
克隆载体:具有克隆载体的基本元件(Ori,Ampr,MCS等),可以携带DNA片段或外源基因进入受体细胞并克隆和大量扩增DNA片段(外源基因)的载体。
表达载体:克隆载体中加入一些与表达调控(具有转录/翻译所必需的DNA顺序)有关的元件即成为表达载体。
载体组成元件
1、复制起始位点Ori:即控制复制起始的位点。Ori的箭头指复制方向,其他元件标注的箭头多指转录方向(正向)。
2、抗生素抗性基因:可以便于加以检测,如Amp+ ,Kan+
(1)Ampr:水解β-内酰胺环,解除氨苄的毒性。
(2)tetr :可以阻止四环素进入细胞。
(3)camr:生成氯霉素羟乙酰基衍生物,使之失去毒性。
(4)neor(kanr):氨基糖苷磷酸转移酶,使G418(卡那霉素衍生物)失活。
(5)hygr:使潮霉素β失活。
3、多克隆位点:MCS克隆携带外源基因片段,它具有多个限制酶的单一切点,便于外源基因的插入。如果在这些位点外有外源基因的插入,会导致某种标志基因的失活,便于筛选。决定能不能放目的基因以及如何放置目的基因。还要再看外源DNA插入片段大小。质粒一般只能容纳小于10kb的外源DNA片段。一般来说,外源DNA片段越长,越难插入,越不稳定,转化效率越低。
4、P/E:启动子/增强子
5、Terms:终止信号
6、加poly(A)信号:可以起到稳定mRNA作用
示例阅读载体:
pENTER载体
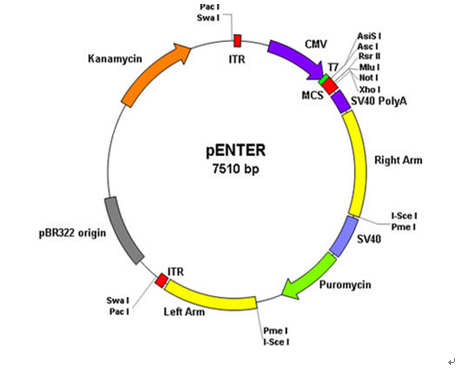
1)human ORF + pENTER载体
2) CMV启动子,T7启动子
3) ORF的C端融合了Flag和His tag
4) 多克隆位点,常用AsisI 和 MluI(人源基因上不常见的)
4) SV40 poly(A)加尾信号
5) SV40启动子启动的puro标记
6) 2个腺病毒ITR序列和2个与腺病毒Ad5同源的序列,可用于将ORF序列同源重组到腺病毒载体,直接用于腺病毒的生产。
慢病毒载体

1)EF1a启动目的基因(可添加小标签FLAG或HIS等小标签)
2)CMV启动GFP,非融合抗性筛选标记Puro(便于做细胞株的稳筛)
3)WPRE(来自土拨鼠肝炎病毒的转录后调节元件),放置在目的基因的上游,能加强转基因的表达
4) cPPT(来自HIV-1整合酶基因),增加慢病毒在宿主基因组的拷贝数,提高病毒滴度
5)第三代慢病毒载体,载体中还包含HIV-1基因组中的顺式调节元件(ψ 包装 信号和LTR 长末端重复序列,其中3’LTR增强子功能缺失,5’LTR中U3区替代为CMV,更加安全的病毒载体)
腺相关病毒载体

AAV表达载体包括了中两个ITR + CMV(可替换其他组织特异性启动子,见改造载体部分)+ globin intron 内含子序列 + 目的基因 + poly A序列
二、选择和准备载体
选择载体主要依据构建的目的,同时还要考虑载体中应有合适的限制酶切位点等。如果构建的目的是要表达一个特定的基因,则要选择合适的表达载体。选用哪种载体,还是要结合目的基因及载体特点以实验目的为准绳。
载体选择主要考虑下述3点:
1、构建DNA重组体的目的,克隆扩增/表达表达,选择合适的克隆载体/表达载体。
2、载体的类型:
(1)克隆载体的克隆能力—据克隆片段大小(大选大,小选小)。尤其对于病毒载体来说,载体包装容量的大小是评估能否成功包装病毒的首要因素。
①腺病毒可以插入长约8kb的外源基因。目前,我们包装过长度为7.5kb外源基因的腺病毒。
②慢病毒的包装容量约为6kb(包含载体带有的其他抗性基因或报告基因),但是2kb以上的外源基因包装慢病毒难度就增加了,增大1kb会下降1个单位数量级的滴度,故2kb以上的基因包装慢病毒需要进行评估。此外,毒性蛋白、凋亡蛋白和膜蛋白(作为受体、转运蛋白行使功能)等由于其本身的功能,包装可能会有一定难度。
③AAV的总包装容量是4.7 kb(包含载体中两个ITR约0.3kb +具体启动子 + 内含子约0.6kb + 具体荧光标签 + polyA约0.2kb),所以插入目的基因一般约2kb 左右。由于AAV包装容量有限,目的基因大于2kb,可考虑去除内含子,因为内含子只是有助于插入的目的基因稳定表达。
(2)确定表达蛋白的目的,然后再来选择优势的表达质粒。一般分为原核表达和真核表达质粒,前者主要用于体外纯化蛋白,如带His-tag的PET系列,带GST-Tag的PGEX系列,选用不同的表达载体,就得建立相应的纯化系统,包括缓冲液的配置、珠子/柱子的选择等等,还得考虑目的蛋白的可溶性,一般大tag的融合蛋白可溶性要好一些,如GST的。这种原核纯化的蛋白一般用来制备单一的、需要量大的蛋白。真核表达载体一般是细胞、体内表达等需要时所用,只需要将它放到细胞或体内细胞即可,唯一考虑的是它的启动子的选择,常用都是cmv启动子的,表达效率较高,也有多种启动子经过改造的表达载体,一般用来表达需要调控表达时间及表达量的蛋白。
①选分子量小的质粒,即小载体(1-1.5kb)→不易损坏,在细菌里面拷贝数也多(也有大载体);
②一般使用松弛型质粒在细菌里扩增不受约束,一般10个以上的拷贝,而严谨型质粒<10个;
③必需具备一个以上的酶切位点,有选择的余地;
④必需有易检测的标记,多是抗生素的抗性基因。
选择载体还需注意:
无标签载体,起始/终止密码子都要添加!
标签在N端的载体,终止密码子要添加!
标签在C端的载体,起始密码子要添加!
(详细解读如下)
①对于无起始密码子和终止密码子的基因,插入无标签的载体要加入起始密码子和终止密码子。
②载体N端有标签,上游引物要对读码框;下游引物要加终止密码子(为了保证基因的表达,少翻译载体序列) 。
链接:对读码框是为了防止移码,是不是移码要看载体图谱,看酶切位点。从ATG开始,要保证三个碱基编码的氨基酸不能影响插入目的基因的正常编码,若影响了插入目的基因的正常编码就要在设计引物的时候在酶切位点前或者后插入一个或者两个碱基,总之是不能影响插入目的基因的正常编码蛋白。有的酶切位点含有起始密码子,如果标签在C端像Nco I就有一个ATG,这时候需要加碱基在酶切位点后面。
③载体C端有标签,上游引物要加起始密码子,且考虑是否加Kozak序列(真核表达系统);下游引物要对读码框,并且要去掉基因本身的终止密码子(保证C端标签表达)。
链接:Kozak序列是位于真核生物mRNA 5’端帽子结构后面的一段核酸序列,通常是GCCGCCRCC(常见的序列是GCCACC),位于起始密码子(ATG)之前。它可以与翻译起始因子结合而介导含有5’帽子结构的mRNA翻译起始。在真核生物中,该序列相对比较保守。对应于原核生物的SD序列(原核基因在mRNA5’端起始密码子AUG上游一段对mRNA的翻译起作用的序列)。
添加Kozak序列的好处:核糖体需要Kozak序列进行稳定结合有助于提高真核基因的转录和翻译的效率。
三、改造载体
1、改造启动子:一般在过表达载体中CMV属于广谱型的强启动子,具体可根据实验需求,选用不同启动子,尤其是对于AAV载体构建时选用组织特异性启动子。
|
启动子名称 |
启动子大小 |
组织特异性 |
|
ALB |
2.4kb |
肝脏特异性 |
|
CAG |
944bp |
广泛表达的强启动子 |
|
CamKIIa |
1.2kb |
大脑皮层和海马神经元特异性启动子 |
|
CMV |
0.6kb |
广泛表达的强启动子 |
|
EF1A |
1.2kb |
广泛表达的启动子(尤其在体内稳定表达) |
|
GFAP |
1.0kb |
星形胶质细胞特异性启动子 |
|
aMHC |
0.4kb |
心肌α肌球蛋白重链启动子 |
|
cTNT |
702bp |
心肌特异性 |
|
Synapsin |
471bp |
成熟神经元特异性启动子 |
|
Rpe65 |
700bp |
视网膜特异性 |
|
3Xenhancer McK |
728bp |
小鼠中肌肉特异性启动子 |
|
NSE |
1.3kb |
神经元特异性烯醇化酶启动子 |
2、实验目的的需要:
①构建过表达or干扰载体
根据实验用途选择载体,如过表达载体通常选用CMV启动子,CMV因其集中了细胞转录因子结合位点而具有异常高的活性,是公认的真核表达中的增强子,一般插入某个基因的CDS区到CMV启动子下游,CMV负责启动该基因的表达,从而达到调高该基因表达的作用;而U6和H1更多的是用于shRNA的启动来达到敲低一个基因的作用,U6和H1启动子都是RNA聚合酶Ⅲ依赖的启动子,其特点是启动子自身元素均位于转录区的上游,适合于表达约21个核苷酸和约50个核苷酸茎环结构(stem loop),RNA聚合酶Ⅲ有明确的起始和终止序列,当RNA聚合酶Ⅲ到连续4个或5个T时,它指导的转录就会停止。
我们公司的shRNA病毒载体(包括腺病毒载体、慢病毒载体和腺相关病毒载体)是由U6或H1 启动shRNA 实现,并连接了报告基因,可以实时监测载体的转染效率。构建干扰载体针对目的基因(目的基因需要大于0.7kb,若小于0.7kb需要评估来确保能设计出8条shRNA序列),设计并提供4个针对靶基因的shRNA产品,确保4个shRNA中的1个产品在细胞感染效率达80%以上的前提下,在mRNA水平至少有70%的沉默效果;也可以按照客户的要求来设计,由客户确定shRNA 序列的长度,对于每条选定的靶序列,设计正义链和反义链,以 loop茎环结构相连,合成shRNA。
②是否携带GFP等荧光标签
携带荧光标签基本目的是为了观察感染目的细胞的效率;携带该标签的好处之一是不用破碎组织细胞和不加任何底物,直接通过荧光显微镜就能在活细胞中发出绿色荧光,实时显示目的基因的表达及定位情况,而且荧光性质稳定。但是,由于GFP标签比较大(约720bp),这种大标签在位置上对目的基因造成了空间位阻作用,对蛋白的空间结构产生一定影响,从而不利于目的基因蛋白本身的活性及正常功能的发挥。此外,还需要结合蛋白本身的特性,比如该蛋白为具有切割活性的蛋白,即使融合了GFP,标签很有可能会被破坏,终究会影响GFP的荧光及基本功能。一般不建议融合这么大的标签,实验需要带荧光标签,建议构建载体时通过P2A非融合。
③是否融合6×His、HA、Myc、FLAG等小标签
为了做免疫共沉淀实验或者WB检测蛋白表达,需要加融合小标签。多数情况下,由于多肽标签相对较小,对目的蛋白质结构影响小。但是在蛋白合成肽链的过程中,如果影响了蛋白的折叠,也会造成目的蛋白活性的下降甚至功能的丧失。
④是否含有表达系统元件,即启动子-核糖体结合位点-克隆位点-转录终止信号。
链接:启动子:促进DNA转录的DNA序列,这个DNA区域常在基因或操纵子编码区的上游,是DNA分子上可以与RNA聚合酶特异性结合并使之开始转录的部位,但启动子本身不被转录。
增强子:为真核基因组(包括真核病毒基因组)中的一种具有增强邻近基因转录过程的调控顺序,其作用与其所在的位置或方向无关。即在所调控基因上游或下游均可发挥作用。
沉默子:负增强子,负调控序列。
起作用的序列。
转录终止顺序(终止子)/翻译终止密码子:结构基因的最后一个外显子中有一个AATAAA的保守序列,此位点下游有一段GT或T富丰区,这2部分共同构成poly(A)加尾信号。
3、载体中P2A和IRES的选择:
| IRES 和 P2A 的比较 | ||
|---|---|---|
|
|
IRES |
P2A |
|
定义 |
IRES内部核糖体进入位点序列:是一段约500bp的核酸序列,这类RNA序列能折叠成类似于起始tRNA的结构,从而介导核糖体与RNA结合,能独立的起始蛋白翻译。 |
P2A肽(2A peptide)是一种可"自我剪切"的短小肽链,最初在FMDV中发现,约22个氨基酸,2A肽可在蛋白翻译时通过核糖体跳跃从自身最后2个氨基酸C末端断裂。 |
|
优点 |
IRES被放置于两个ORF之间的时候,可以同时表达这两个ORF。由于两个ORF分别有自己的起始密码子和终止密码子,所以会翻译两个独立的、没有经过修饰的蛋白。 |
两个基因(ORF)通过2A多肽链连接成为一个ORF,mRNA翻译成一个融合蛋白,但这两个融合蛋白会被识别2A的蛋白酶切成两个蛋白。这两个蛋白的摩尔比理论上是1:1。 |
|
缺点 |
IRES的存在有时候会影响mRNA的结构,同时由于IRES和mRNA的5’CAP对核糖体/或翻译起始复合物的结合力不同,IRES后面的ORF翻译蛋白的水平有可能与IRES前面的ORF蛋白水平不一致。有的时候前面的ORF表达很好,但后面的ORF表达水平不高;有的时候后面的ORF和/或IRES会影响前面ORF的表达,甚至前面的ORF根本不表达。 |
2A是一个大约22个氨基酸的多肽。蛋白酶切割会发生在2A多肽C端的甘氨酸(G)和脯氨酸(P)之间。所以,前一个蛋白的尾巴上会留下一个20多个氨基酸的多肽。后面一个蛋白的N端会留下一个多余的脯氨酸。尤其是第一个蛋白,如果是一个小分子(比如分泌型的细胞因子),可能其功能会受到这20多个氨基酸的影响。 |
|
建议 |
IRES序列后基因的表达效率显著低于IRES序列前基因的表达,所以与IRES相比,2A肽具有以下优点:(1)2A序列短,能够有效地实现连接基因之间的共表达;(2)位于2A下游的基因同样可以获得很高的表达水平。 |
|
四、影响载体选择的因素:
▪ 原核表达 or 真核表达
▪ 细胞实验 (过表达 or 干扰、瞬时表达 or稳转株、基因大小、荧光、药筛 )
▪动物实验 (过表达 or 干扰、注射部位、基因大小、观察周期 )