当前位置:首页 > 专题 > 分子生物学
当前位置:首页 > 专题 > 分子生物学
慢病毒(Lentivirus)是一类改造自人免疫缺陷I型病毒的病毒载体,是逆转录病毒的一种,基因组是单链RNA。区别于腺病毒和腺相关病毒,慢病毒能够介导外源基因整合至宿主基因组,实现基因长时间稳定表达,是体内外基因传递的有效工具。
那什么情况下可以选用慢病毒载体呢? 这就需要根据实验目的和慢病毒的特点来进行选择:
1. 如果需要感染的目的细胞是一些难转染的细胞(如原代细胞、干细胞、不分化的细胞)或者是对腺病毒感染具有较强免疫反应的细胞(如树突状细胞、单核细胞和间充质干细胞)时,可以选择慢病毒载体,能大大提高目的基因转导效率及整合至宿主基因组几率。
2. 慢病毒的宿主范围广泛,既能感染分裂细胞,也能感染非分裂细胞,所以体内外研究中均可以选用慢病毒作为病毒载体。如果需要构建活体动物模型,尤其是动物成瘤实验,慢病毒是很好的选择。
3. 当需要将外源基因整合到宿主染色体上,实现目的基因稳定、长期的表达时,或者后续需要构建稳转株,那么慢病毒则是理想选择。
4. 慢病毒载体也可以改造T细胞用于CAR-T细胞治疗和基因治疗。与其他病毒载体相比,慢病毒生产成本相对较低,而且整合模式致癌风险较低,因此用慢病毒载体生产CAR-T细胞更加经济且安全有效。
慢病毒既可以感染分裂细胞与非分裂细胞,还能将外源基因整合到宿主染色体上,从而实现长期稳定的表达,是体内和体外基因传递的有效工具。然而慢病毒感染效率受到多种因素的影响,今天就一起分析一下影响慢病毒感染效率的因素:
首先,考虑病毒包装制备是否存在问题,比如外源基因是否正确,病毒滴度是否合格等。其次,考虑病毒运输和保存方式是否得当,解冻病毒一定要在冰上进行,尽量避免反复冻融,否则会影响病毒滴度;分装的病毒-4℃可以保存3天,-80℃保存半年以上需要重新测定滴度。
细胞良好的生长状态是达到高感染效率的保证,一般选择细胞形态较好、轮廓清晰、处于对数生长期的细胞进行感染可提高感染效率。
理论上MOI值越大,慢病毒感染上的可能性也越大,感染效率越高,但对细胞的毒性也越大(需要的MOI值越大,表明目的细胞越难被感染,慢病毒对细胞的毒性也越大)。所以实验中可以通过预实验确定合适的MOI值来达到相对较高的细胞存活率和病毒感染率。
慢病毒一般在感染后24h换液。感染后换液太早会导致感染效率下降;感染后换液太晚,则对细胞的损伤太大,效率也不高(如果慢病毒对细胞有明显毒性,可根据细胞生长状态在4-24h后换液)。由于慢病毒的表达较慢,荧光表达所需时间较长,可在感染72~96h后观察荧光的表达。
MOI(multiplicity of infection),即感染复数,指的是感染时病毒与细胞数量的比值。一般认为MOI是一个比值,没有单位。合适的MOI值是高感染效率的关键因素之一,那么如何确定合适的MOI值呢?
1. 查阅相关文献,推荐查阅与目的细胞的种类、细胞状态、实验条件相似的有参考性的文献,对MOI值的适宜范围有基本的了解。
2. 进行预实验,因慢病毒种类、实验条件、细胞状态、实验人员熟练程度等的不同,文献报道的MOI值也只能作为参考,推荐正式实验前在目的细胞中进行预实验(如梯度实验)来摸索合适的MOI值。
3. 选取预实验中细胞状态较好、荧光较多的孔对应的MOI值作为正式实验时使用的MOI值。
下面提供一种慢病毒感染细胞的预实验以摸索MOI值的操作步骤以供参考:

别人的慢病毒感染实验进行的如火如荼,你还在苦苦翻阅文献查找MOI值?别急,我们来了!经过大量文献的查阅,总结了常用人源、鼠源细胞的MOI值供您参考。
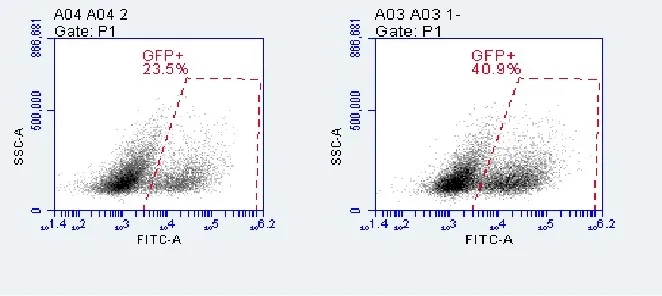
慢病毒感染后,细胞可能会出现生长状态变差或有大量黑点出现进而影响生长等问题,下面就一起分析一下这些问题出现的原因及解决方法:
病毒溶液中残留的杂质蛋白、内毒素等会对细胞造成一定的毒性,不同细胞对毒性的耐受力不同。如果所选择的目的细胞对慢病毒比较敏感,则可能出现细胞状态变差甚至死亡的现象。针对这种状况有以下几点解决方法:一是保证感染前细胞的生长状态良好;二是使用高纯度高滴度的慢病毒,并适当降低感染时使用的MOI值,即可在细胞准备感染时增加铺板细胞的融合率(可提高至70%),调整感染时加入的病毒量;三是根据细胞状态,可选择在感染4小时后换液,用新鲜的完全培养液继续培养观察。
在排除细菌及真菌污染后,细胞中的黑点通常为细胞碎片。在慢病毒感染后,细胞破碎通常有两个原因:a、慢病毒使用量过多,或细胞数量过少;b、支原体污染。由于轻度的支原体污染并不影响细胞的生长增殖,故支原体污染被许多实验室所忽略。但支原体在病毒感染细胞后爆发,故会出现大量细胞碎片。针对以上原因建议的解决方法有:一是调整MOI值,确定合适的病毒使用量;二在使用病毒制品时,应首先排除细胞、培养物及培养环境中的支原体污染,以保证实验的顺利进行。
慢病毒已作为细胞治疗的理想载体得到广泛应用,然而在感染过程中仍会出现感染效率低的问题,下面就介绍两种可以提高慢病毒感染效率的助感染试剂,一起来围观吧~
悬浮细胞是一类生长不依赖支持物表面,在培养液中呈悬浮状态生长的细胞。与贴壁细胞相比,悬浮细胞难培养,易死亡,且不易转染。维真生物团队研发的慢病毒转导增强剂 LVTE 可以解决这一难转染问题,其使用原理是增强膜的通透性和细胞内外的跨膜转运,促进慢病毒进入靶细胞,进而大大提升慢病毒对悬浮细胞这类难感染细胞的感染效率。
使用方法:
(1)直接加入法(适用于较易感染的细胞类型)
①进行病毒感染时,将LVTE稀释100倍直接加入培养皿/孔/瓶中,混匀即可;
②后续操作过程依据病毒类型和实验需要而定;
(2)离心法(适用于较难感染的细胞类型)
以“24孔培养板、人原代T细胞”为例:
① 准备细胞将状态良好的目的细胞接种到 24 孔板中,每孔按5×10E5个待感染细胞铺板,每孔400uL培养基;
② 选择合适的MOI值于24孔板中加入慢病毒,再加入4uL慢病毒转导增强剂LVTE,轻轻混匀,800g室温离心45min;
③ 离心后将24孔板置于37℃、5%CO2 培养箱中静置5-6h;
④ 静置完成后在培养体系中补加800uL培养基继续培养;
⑤ 48-72h后鉴定病毒感染效率。
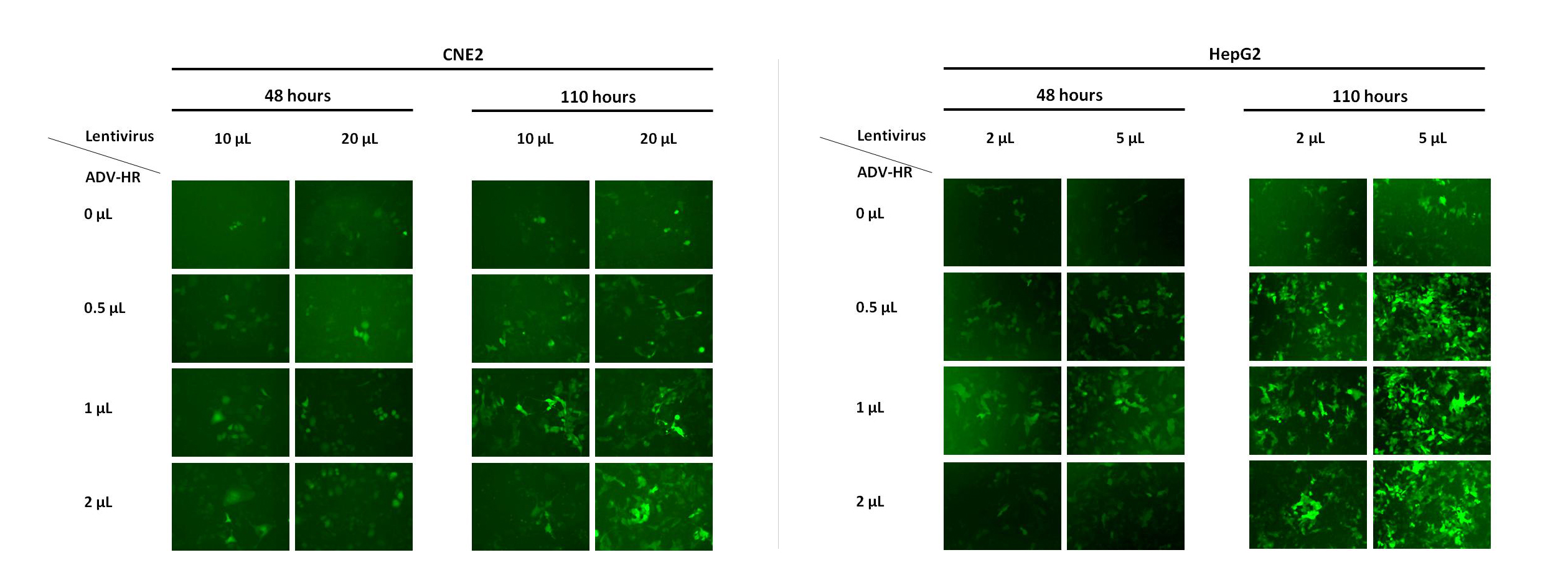
维真团队研发的 ADV-HR 通过物理吸附将病毒富集在细胞表面,从而增加病毒对细胞的感染效率,起到助感染的效果,可以提高贴壁细胞的病毒感染效率。此试剂既可以用于慢病毒感染,也可以用于腺病毒感染过程。高浓度的ADV-HR具有细胞毒性,影响细胞状态和感染效率,建议您务必于目的细胞中进行ADV-HR浓度梯度预实验。
使用方法:
(1)直接加入法(适用于较易感染的细胞类型)
进行病毒感染时,将ADV-HR、慢病毒直接加入培养皿/孔/瓶中,混匀即可。
(2)孵育法(适用于较难感染的细胞类型)
将ADV-HR、慢病毒和一定数量的细胞悬液加至1.5mL Eppendorf 管中,轻轻混匀,置于37℃细胞培养箱中孵育0.5-1个小时后转移至预先加有2ml培养液的6孔板中,37℃、5%C02培养箱中培养。后续操作依病毒类型和实验需要而定。