维真生物腺相关病毒包装采用的是经典的三质粒共转染法(Helper-free AAV包装系统,即AAV无辅助病毒系统),该系统包括3个载体和1株包装细胞:3个载体【载体质粒(含有目的基因表达盒,其两端是AAV2的反向末端重复序列)、包装质粒(反式提供具有AAV复制和包装功能的蛋白Rep和Cap)和辅助质粒(含有辅助病毒Ad5的重要元件E1a、E1b、E2a、E4等)】和1株包装细胞(HEK293T cell)。腺相关病毒包装的具体示意图如下:
|
|
1. 腺相关病毒重组载体构建
1) 根据客户实验目的和受试细胞选择不同的载体,在此以人源ORF为例。
2) 维真生物公司AAV载体的MCS区与人源ORF cDNA克隆现货库中的MCS区相兼容,可以通过简单酶切-连接-转化的方式将目的基因亚克隆至目标AAV表达载体,得到阳性克隆后通过测序以确认插入片段的正确性。
2. 细胞冻存
1) 按照细胞培养流程,将对数生长期的细胞吹下来加入50mL离心管中,200g离心5min。
2) 配制冻存液,90% 血清,10% DMSO,混匀。
3) 离心后去上清,将配制的冻存液加入,将细胞吹匀。
4) 取上述溶液每1mL分至1.5mL 细胞冻存管中,做好标记和日期。
5) 将冻存管放入装有异丙醇的冻存盒中,放入-80℃冰箱过夜。(冻存盒要提前一天从冰箱中拿至室温,使异丙醇的温度达到室温,每次冻存前确保异丙醇的加入量在刻度线上);
6) 第二天将冻存盒放入液氮或 -150℃冰箱中以长期保存;同时取一支细胞做复苏检测,以判断该批细胞的冻存质量。
3. 细胞复苏
1) 10cm dish中加10ml新鲜DMEM培养基,放培养箱预热至37℃。
2) 从液氮中取出冷冻管,迅速投入 37 ℃~38℃水浴中,使其融化(1-2 分钟左右)。
3) 待细胞冻存管中溶液融化后,200g离心5min,弃掉液体并吸取1ml预热的培养基将细胞沉淀轻轻吹起,转移到10cm dish中。
4) 摇晃均匀,置于培养箱培养。
5) 培养过夜,更换新鲜培养基(除去冻存液中DMSO对细胞的毒害作用)。
4. 细胞传代(以10cm dish为例)
1) 生物安全柜紫外灭菌半小时。
2) 灭菌期间,将DMEM培养基(含10%FBS,1%青链霉素混合液)和PBS置于37℃水浴锅中预热;0.25% 胰酶放置室温,不可水浴加热。
3) 取汇合度接近100%且活性较好的HEK293T 细胞,吸弃培养盘中培养基,加入约5mL,1×PBS,摇晃几下,吸弃PBS。
4) 加1mL 0.25% 胰酶在生物安全柜内消化约1min,室温低时可放置于培养箱中消化。消化时间不宜过长,否则影响细胞再次贴壁效率和活性。
5) 加入约5mL预热的培养基,终止消化。
6) 用移液管吹打均匀(吹打过程中不可用力过大,否则会吹破细胞),按照1:3的比例传代。各取2mL培养基至新的10cm dish中,再加入 8mL预热的DMEM 培养基。
|
注意:
|
传代盘数较多时,要先将预热的 DMEM 培养基加入到 10cm dish中,再加入含细胞的培养基,以避免细胞分布不均匀。置于培养箱前轻轻混匀dish中的培养基,使细胞均匀分散于培养基中。
|
5. AAV病毒包装(以10cm dish为例)
Day1:汇合度90%以上的HEK293T细胞按1:3比例传盘(每盘大约2.5× 106),培养基为Hyclone高糖DMEM培养基(含10%FBS)。
Day2:转染前1-2h左右,换成无血清培养基。
按照以下比例配制转染试剂:
| Mix 1 | 体积μl | Mix 2 | 量 |
| DMEM(无FBS) | 500μl | DMEM(无FBS) | 500μl |
| LTR-plasmid | 5μg | ||
| VGF | 60-70μl(1μg/μl) | RC-plasmid | 6μg |
| AAV-helper | 10μg |
Mix 1和Mix 2分别混合后,室温5-10min, 后将Mix 1和Mix 2混合,室温15-30min,逐滴加入至10cm dish中。(此时细胞汇合度在80%-90%比较适宜,细胞过少会影响转染效率)
Day3:质粒转染24h后,换新的无血清培养基。
Day5:转染72h收毒,将产毒的细胞连同培养基一起收集至50ml离心管中,离心,分别收获培养基上清与细胞沉淀:PEG8000沉淀培养基上清中的病毒;裂解细胞沉淀收毒;合并从细胞沉淀和上清中得到的AAV。
6. AAV 病毒纯化与浓缩
6.1 纯化——碘克沙醇密度梯度离心。
① 配制不同浓度的碘克沙醇;
② 取一个超离管,用电动移液器逐层、缓慢加入不同浓度的碘克沙醇;
③ 将处理好的病毒液加入到最上层;
④ 配平后超速,18℃、48000rpm、2.5h离心。
6.2 浓缩
① 离心完毕后,将超滤管底用针头刺破,收集腺相关病毒所在层至15mL管中;
② 将收集的病毒液注入浓缩柱中,加PBS+0.001%PF68至满,混匀;
③ 4000rpm,10℃,离心约1h。
④ 将超滤管中剩下的液体反复吹打后吸至病毒储存管中,最后加入病毒储存液,标明名称和日期。
⑤ 将收集起来的病毒涡旋震荡混匀后离心,吸 10μL 病毒液进行滴度检测。
7. 病毒滴度检测方法
实时定量PCR法是一种简单的、高通量的测定纯化病毒样本中腺相关病毒颗粒数量的方法。每个模板的Ct值与该模板起始拷贝数的对数存在线性关系,利用已知起始拷贝数的标准品可作出标准曲线,最后通过标准曲线对未知模板进行定量分析。
7.1 去除游离DNA分子
先将病毒稀释10倍,以保证样品中游离的DNA充分降解:取5μl病毒至45μl PBS缓冲液中,充分混匀。按以下体系配制Mixture:
| 组成成分 | 体积 |
| 超纯水(DNase & RNase Free) | 4 μl |
| DNAaseI | 1 μl |
| 10×DNAaseI Buffer | 1 μl |
| 病毒稀释液 | 4μl |
| Total | 10μl |
37 ℃ 孵育 30 min,95℃加热 5min 使 DNA 酶失活。
7.2 去除病毒蛋白外壳
向上述体系中再加入 1μl 蛋白酶 K(5μg/μl)。37 ℃ 孵育 30 min;再加30ul超纯水稀释至40ul(至此病毒原液稀释100倍),95℃加热 5 min使蛋白酶 K 失活,然后 12000rpm,离心 2min,取上清进行 qPCR 检测。
37 ℃ 孵育 30 min,95℃加热 5min 使 DNA 酶失活。
7.3 qPCR
将步骤2得到的上清,取 5μl 进行 10 倍梯度稀释,即病毒原液稀释了 1000 倍。分别取 2μl 待测样品及标准品作为模板进行 qPCR 检测。
qPCR反应体系如下:
| 组成成分 | 体积 |
| 2 × SYBR Green mix | 10 μl |
| Primers (Forward & Reverse mixture) | 0.8 μl |
| 超纯水(DNase & RNase Free) | 7.2μl |
| DNA | 2μl |
| Total | 20μl |
qPCR反应程序:
| 循环参数 | |
| 预变性95℃ | 3min |
| 95℃ | 5S |
| 60℃ | 15S |
| 72℃ | 15S+Plate Read |
| 39个循环 | |
7.4 数据分析
病毒颗粒数的计算:病毒颗粒数(VP/mL) = 与标准品相对值×1000
|
附件1:载体选择 |
|
基因过表达 |
||
|
|
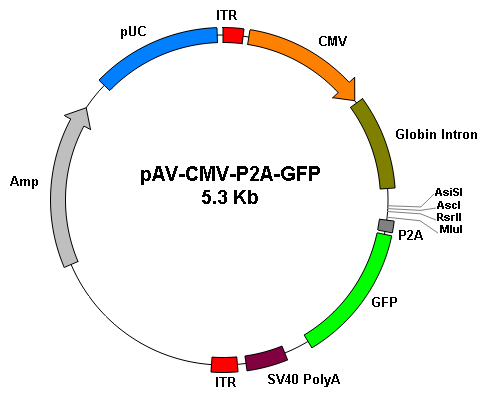
|
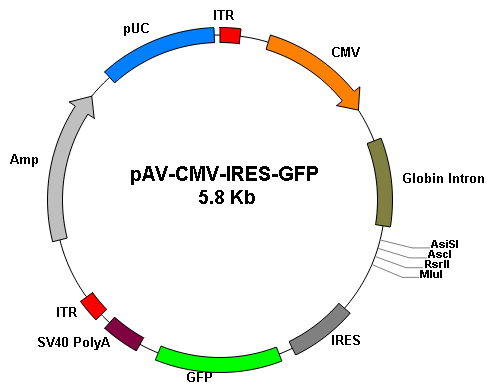
|
|
|
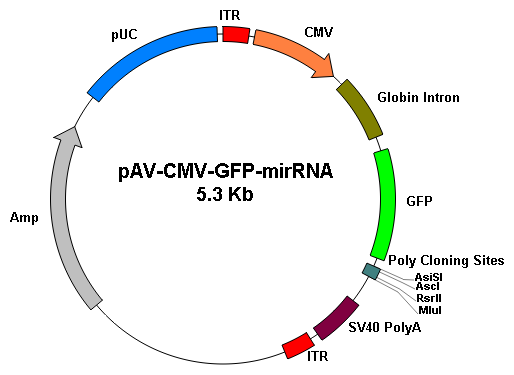
|
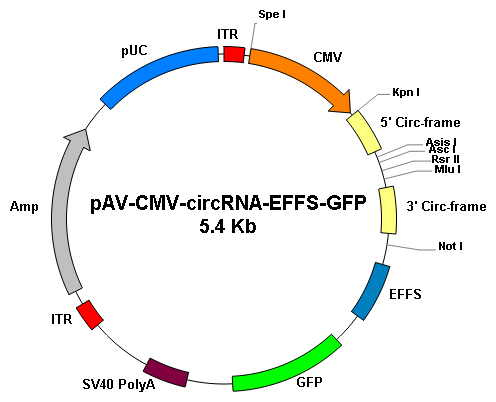
|
|
|
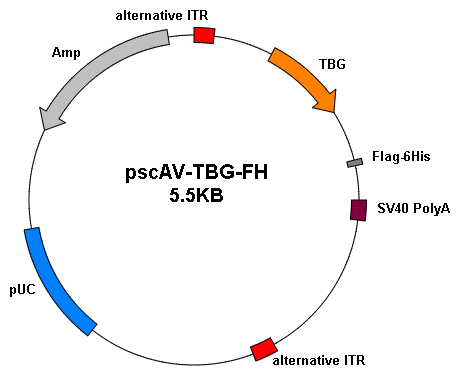
|
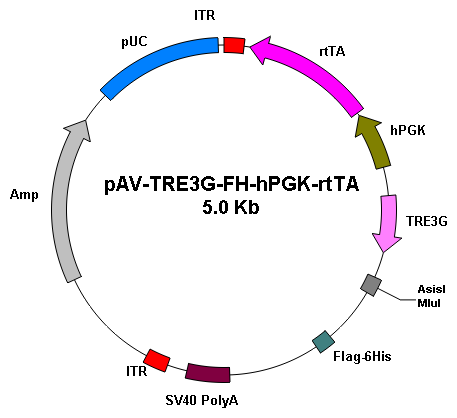
|
|
基因沉默 |
||
|
|
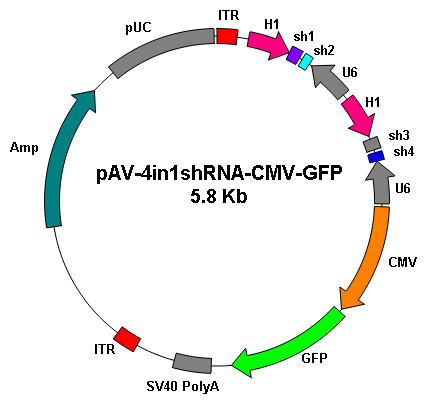 |
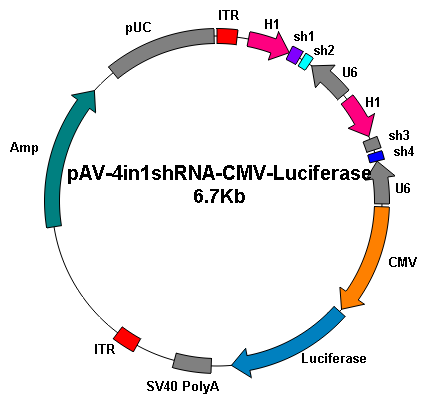
|
|
|
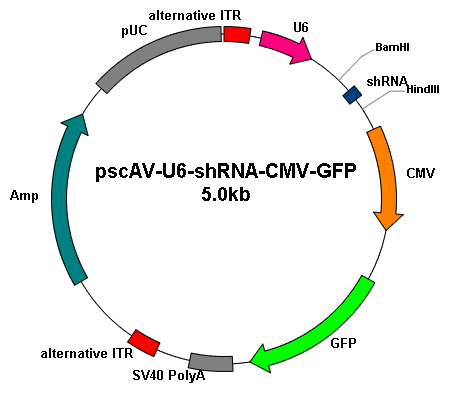
|
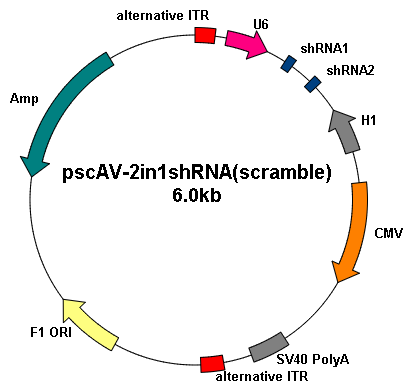
|
|
基因编辑 |
||
|
|
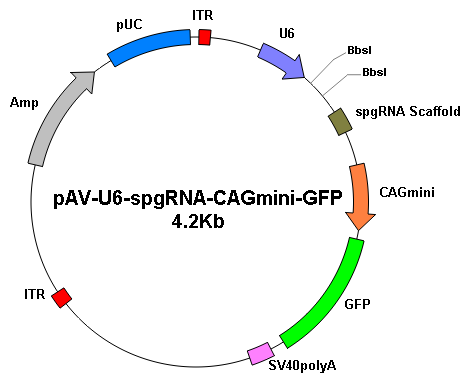
|
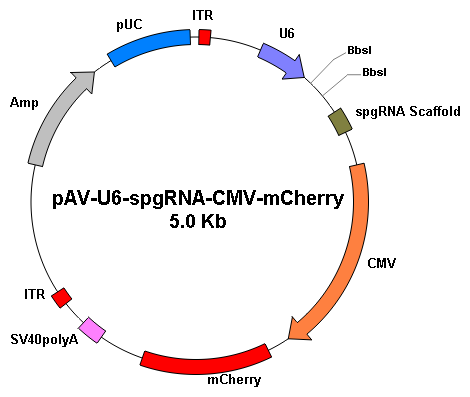
|
|
附表2:耗材 |
| 耗材名称 | 货号 | 品牌 |
| 细胞培养板 10cm | 704001 | NEST |
| 细胞培养板 15cm | 715001 | NEST |
| 10ml血清移液管 | 4488 | Corning |
| 50ml血清移液管 | 4490 | Corning |
| 100-1250无菌加长带刻度滤芯枪头 | TF112-1000-Q | QSP |
| 细胞冻存管 | 377267 | Corning |
| DMEM高糖培养基 | C11965500BT | GIBICO |
| HEPES溶液 1M | SH30237.01 | HyClone |
| 青霉素-链霉素溶液(100*) | C0222 | 碧云天 |
| 胎牛血清 | 1122050 | Gibico |
| 0.25%胰蛋白酶 | SH30042.01 | Hyclone |
| 10xPBS | ST476 | 碧云天 |
| DMSO | D8372 | SOLARBIO |
|
附表3:仪器 |
| 仪器名称 | 规格型号 | 品牌 |
| 生物安全柜 | BSC-1300IIA2 | 苏净集团苏州安泰空气技术有限公司 |
| 倒置显微镜 | CKX31SF | OLYMPUS |
| 实时荧光定量扩增仪(QPCR仪) | CFX96 | BIO-RAD |
| 荧光显微镜 | ELWD0.3 | Nikon |
| 超低温保存箱 | DW-86L386 | 青岛海尔特种仪器有限公司 |
| 台式高速冷冻离心机 | 1580R | LAB GENE 基因有限公司 |