 当前位置:首页 > 研究领域 > 神经系统
当前位置:首页 > 研究领域 > 神经系统
人体器官的功能会随着年龄的增长而逐渐衰退,脑也不例外。脑衰老会产生涉及分子、细胞和功能水平的特征性神经生理变化,了解这些变化及其分子机制对于研究脑衰老及其相关性疾病具有重要的意义。脑衰老的生物学机理十分复杂,与遗传、年龄和环境等多个因素有关,其中随年龄和环境等因素而变化的表观遗传调控被认为是重要的调节因素之一。
已有研究报道哺乳动物脑中存在大量的环状RNA(CircRNA)。同时,最近的研究也表明,circRNAs可能作为一种新的调控网络参与大脑的发育、成熟和衰老。但是,大脑中大多数circRNAs的表达模式和功能尚不清楚,尤其是灵长类动物脑中。非人灵长类动物由于其在遗传和生理特征上与人类具有相似性,因此,已成为人类疾病建模和治疗策略研究的最有价值的模型之一。
2018年,为了研究circRNA在哺乳动物,尤其是灵长类动物大脑中的表达特点和调控作用,中国科学院昆明动物研究所李家立团队以猕猴的脑组织为实验材料进行了系统的circRNA表达特点及功能的研究,相关研究成果发表在《Cell Discovery》,题为“Annotation and functional clustering of circRNA expression in rhesus macaque brain during aging”,文章揭示了circRNA的表达在猕猴大脑中呈现组织特异性、性别特异性和年龄特异性,并且circRNA与其宿主mRNA之间存在正相关或负相关调控关系。
2020年7月,中国科学院昆明动物研究所李家立团队又在《Nature Communications》(IF=12.121)上发表了题为“CircGRIA1 shows an age-related increase in male macaque brain and regulates synaptic plasticity and synaptogenesis”的研究论文,文章在上述研究工作基础上发现CircGRIA1的表达在猕猴前额叶皮层和海马区具有年龄特异性和雄性特异性,并且顺式作用于Gria1基因启动子进而调控Gria1基因的表达;体内外操纵circGRIA1表达能够负调节Gria1基因的表达,敲低circGRIA1可显著改善老年雄性猕猴海马神经元的突触可塑性及突触再生。该论文强调了CircRNA调控的重要性,加深了人类对脑衰老生物学的了解。

CircGRIA1是由谷氨酸受体AMPA亚基Gria1基因外显子4,5,6形成的进化保守性circRNA。作者通过qPCR及Northern blot发现CircGRIA1在雄性猕猴脑中呈现增龄性表达升高,且与宿主(Gria1)mRNA表达呈负相关。(图1)
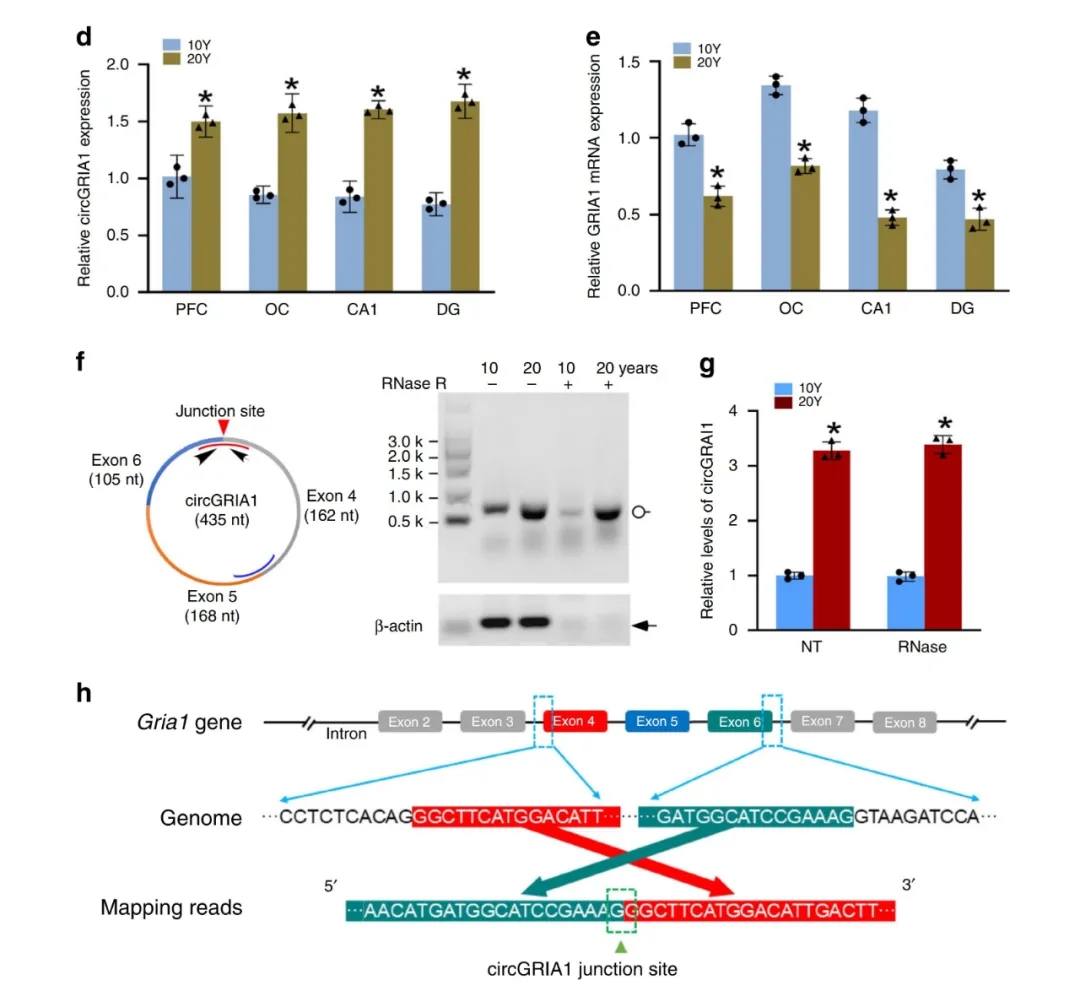
为了进一步验证CircGRIA1与其宿主(Gria1)mRNA之间的负调控关系,作者又用BASEscope ISH和RNAscope ISH技术进行了进一步验证,发现雄性猕猴CircGRIA1的表达在前额叶皮层(PFC)和海马的CA1& DG区呈现随年龄增长而上升的趋势;而其宿主(Gria1)mRNA的表达水平则相反。(图2)

为了探讨CircGRIA1与其宿主(Gria1)mRNA表达负相关的分子机制,作者从体内外用ChIRP技术研究了与CircGRIA1反向剪接点共沉淀的片段,发现CircGRIA1结合其宿主(Gria1)mRNA的5’UTR,进而发挥负调控功能。(图3)

作者使用慢病毒载体(MOI=5-10)感染DIV5的胎猴海马神经元,体外操纵CircGRIA1,通过BASEscope ISH和RNAscope ISH技术检测CircGRIA1和其宿主(Gria1)mRNA的表达,发现DIV28,siRNA感染组的CircGRIA1表达显著降低;而其宿主(Gria1)mRNA的表达水平则升高。(图4)

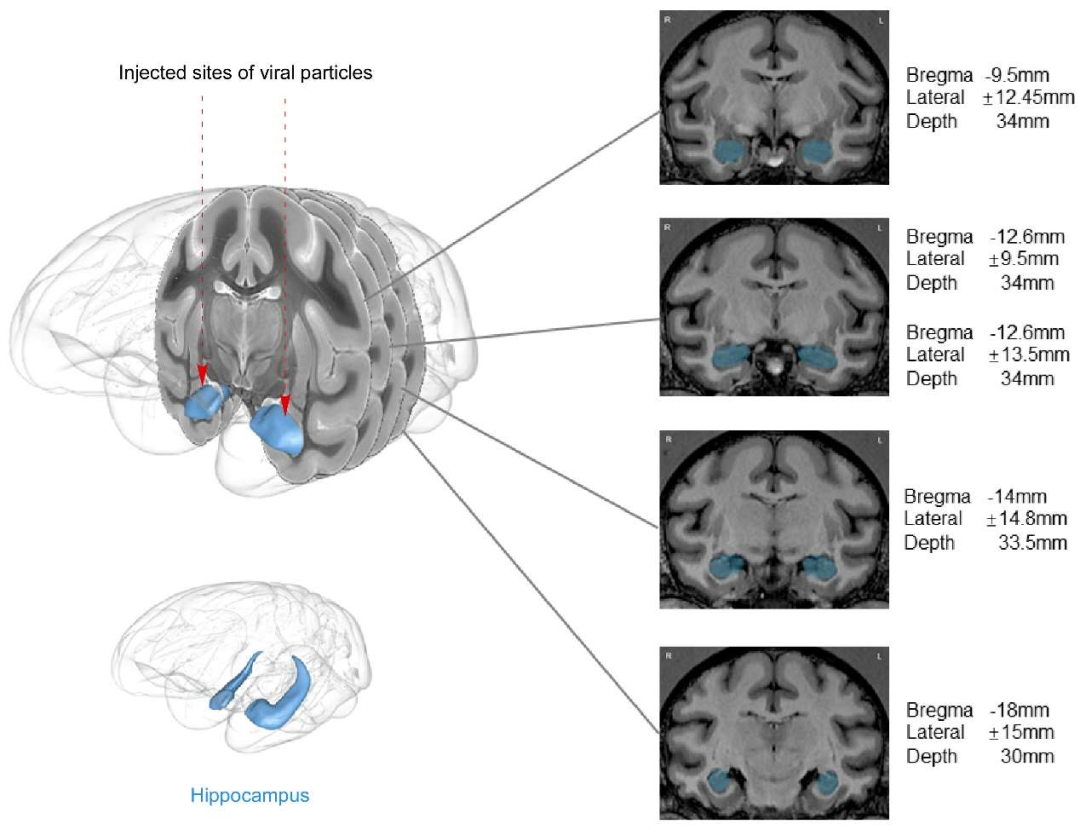
接下来,作者探讨了CircGRIA1和Gria1表达负相关的生理功能,如是否参与了老化过程中突触形成前后的调控。首先,作者将AAV9-siRNAs(CircGRIA1)&AAV9-siRNAs(control)病毒颗粒微注射至10年龄和20年龄雄性和雌性猕猴的海马区,6周后,采用BASEscope ISH、RNAscope ISH和RT-qPCR检测CircGRIA1和Gria1的表达水平,发现20年龄雄性猕猴海马中CircGRIA1表达显著降低,而Gria1 mRNA表达升高。(图5)

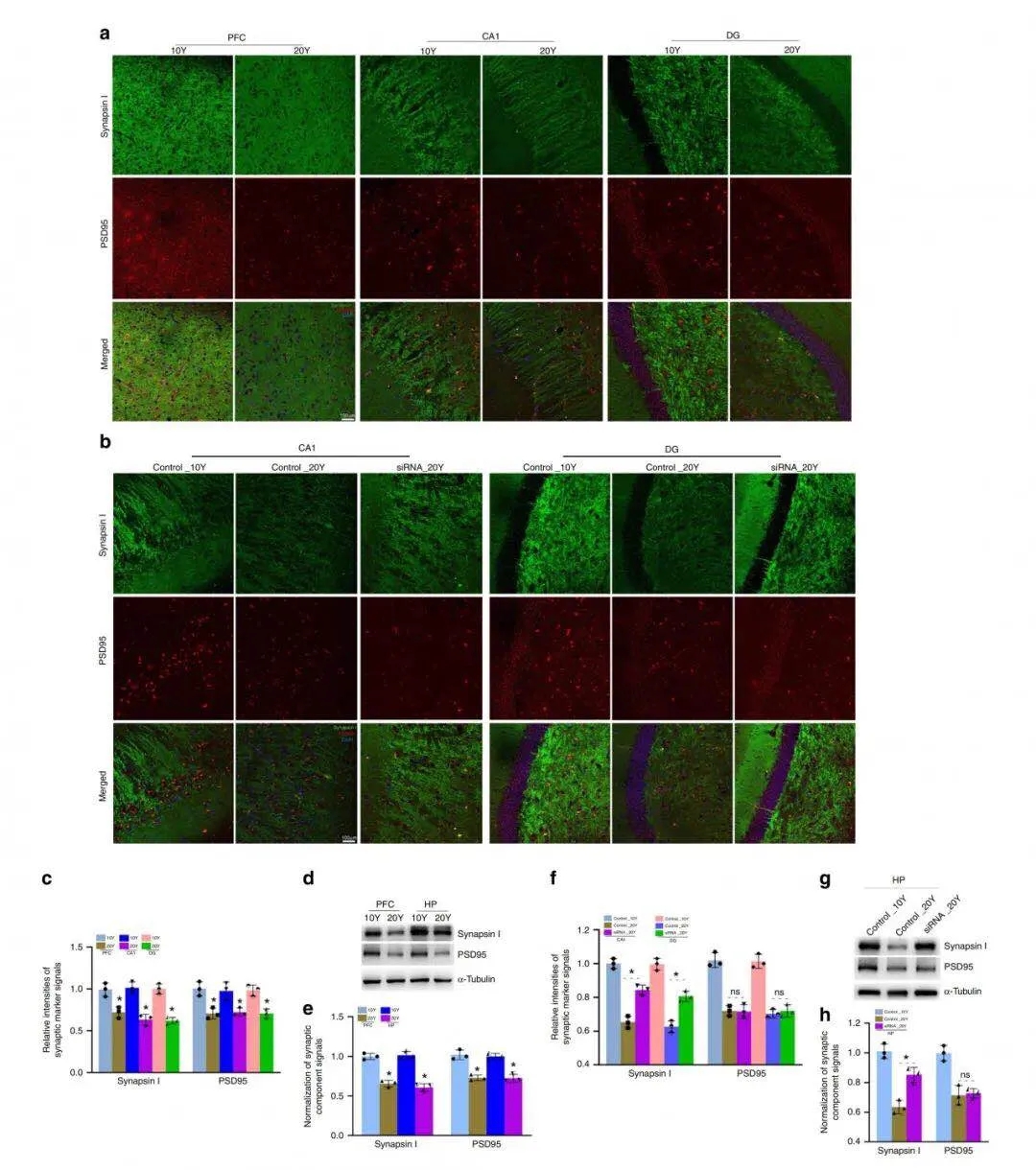
接着,作者从体内外检测了猕猴脑中几个突触组分表达的年龄相关性变化。免疫组织化学结果(见图6)显示,与10年龄雄性和雌性猕猴相比,20年龄雄性和雌性猕猴PFC和海马CA1 & DG区的synapsin-I(突触前囊泡蛋白)和PSD95(突触后膜骨架蛋白)表达水平均显著降低;敲低CircGRIA1显著增加了20年龄雄性猕猴海马中synapsin-I的表达水平,而PSD95表达水平几乎没有变化。CircGRIA1敲低组的体外结果跟体内结果一致。
突触可塑性与谷氨酸受体AMPA和NMDA 介导的神经活动相关。微型自发的兴奋性突触后电流(mEPSCs)用于模拟该神经活动。作者探究了CircGRIA1是否参与突触可塑性。作者使用慢病毒载体(MOI=5-10)感染DIV5的胎猴海马神经元,体外操纵CircGRIA1,跟踪记录不同时间点的mEPSCs。结果显示DIV28,control组mEPSCs的振幅和频率均下降,siRNA感染组则缓解了这种下降。

本研究工作表明CircGRIA1的表达在老年雄性猕猴脑中表达升高。它主要定位于细胞核,其与Gria1基因启动子区域相结合,以顺式作用方式负调控Gria1的mRNA和蛋白水平。体内外敲减CircGRIA1可显著改善老年雄性猕猴海马神经元的突触可塑性及突触再生。这些研究为进一步认识和理解灵长类动物复杂的大脑结构和功能,寻找参与脑衰老进程的调控因子提供了新证据,为探索衰老相关神经疾病的机理和干预措施提供了参考。
本研究工作表明CircGRIA1的表达在老年雄性猕猴脑中表达升高。它主要定位于细胞核,其与Gria1基因启动子区域相结合,以顺式作用方式负调控Gria1的mRNA和蛋白水平。体内外敲减CircGRIA1可显著改善老年雄性猕猴海马神经元的突触可塑性及突触再生。这些研究为进一步认识和理解灵长类动物复杂的大脑结构和功能,寻找参与脑衰老进程的调控因子提供了新证据,为探索衰老相关神经疾病的机理和干预措施提供了参考。
| AAV病毒 | AAV9-shRNA(circGRIA1) & AAV9- shRNA(control) |
| 注射动物 | Three-paired 10- and 20-year-old male and female rhesus macaques weighing 6–10 kg |
| 病毒用量 | 单侧海马5次, 20μL/次 (total 100 μL) , titer ~3 × 1014v.g./mL;对侧海马注射等量对照病毒 |
| 注射方式 | 脑立体定位注射,31-gauge汉密尔顿注射器, rate of 500 nL/min |
| 注射位置 | 海马,见图8 |
| 检测时间 | 6周后 |
维真生物科研团队已成功构建了大量circRNA表达载体,并建立了腺病毒、慢病毒和AAV全套circRNA过表达和干扰载体系统。
| 维真生物circRNA过表达及干扰载体 | |
|---|---|
| 腺病毒载体 | |
| OE(过表达) | KD(敲低) |
|
|
|
| 慢病毒载体 | |
| OE(过表达) | KD(敲低) |
|
|
|
| 腺相关病毒载体 | |
| OE(过表达) | KD(敲低) |
|
|
|
| 欲知更多circRNA相关载体,请拨打技术热线电话:400-077-2566 | |
| 维真生物circRNA专题往期回顾 |
|---|
| 『CircRNA领域新发现』浙江大学范顺武教授课题组发现CircRNA :CircSERPINE2,为骨关节炎治疗提供有效策略 |
| 环状RNA序列查询与引物设计 |
| 环状RNA(CircRNA)与相关服务项目简介 |